题目内容
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
【查阅资料】:
①NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式 。
②NaN3遇盐酸、H2SO4溶液无气体生成;
③碱石灰是CaO和 NaOH的混合物;
④NaN3工业上制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O = NaN3+NaOH+X;则X的化学式为 。
【问题探究】:(一)测定某工业级NaN3样品中Na2CO3的质量分数
(1)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示) ;
(2)某同学设计如图装置测出碳酸钠的质量分数,其实验数据记录如下:
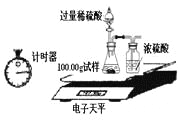
称量项目 | 称量时间 | 质量(g) |
试样 | 100.00 | |
装置+稀硫酸质量 | 241.20 | |
装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
①写出锥形瓶中发生的反应方程式: ;
②若无浓硫酸的洗气装置,会使测定的结果 (填“偏大”、“偏小”或“不变”);
③利用表中数据计算出碳酸钠的质量分数为 。
【问题探究】:(二)测定某工业级样品中NaN3的质量分数
小谈同学精确称量0.140 g NaN3样品,设计如图装置测定其质量分数。
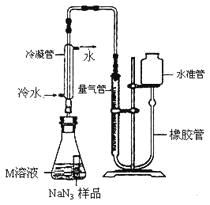
已知2NaN3→ 3N2(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
(1)检查该装置气密性的方法是:连接好装置,从水准管注水, ,说明气密性良好。
(2)使用冷水冷凝的目的是: 。
(3)倾斜锥形瓶使小试管中的NaN3样品与M溶液接触充分反应。 常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A.100 mL B.1 L C.2 L
(4)计算工业级样品中NaN3的质量分数(写出计算过程,结果保留0.1%)。
【答案】【查阅资料】①2NaN3撞击3N2↑+ 2Na ④ NH3
【问题探究】:(一)(1)2NaOH+CO2=Na2CO3+H2O
(2)①Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ ②偏大 ③5.3%
【问题探究】:(二)(1)U形管左右两边会形成液面差 (2)将水蒸气液化 (3)A
(4)92.9%
【解析】试题分析:NaN3受撞击会迅速分解生成Na、N2,写出该反应的化学方程式2NaN3===2Na+3N2;反应的化学方程式为2NaNH2+N2O = NaN3+NaOH+X;根据质量守恒定律知道参加反应的各种原子的个数和种类不会改变的原则可以确定X的化学式为NH3;工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)2NaOH + CO2="==" H2O + Na2CO3,锥形瓶中发生的反应方程式:Na2CO3+H2SO4= Na2SO4+ H2O +CO2↑;②若无浓硫酸的洗气装置,会使测定的结果偏大,可能会带有水分;利用表中数据计算出产生的二氧化碳的质量为2.2克,碳酸钠的质量分数为X,
Na2CO3+H2SO4= Na2SO4+ H2O +CO2↑
106 44
100*X克 2.2克
列比例式得:106:100*X克=44:2.2克 解得X=5.3%
检查该装置气密性的方法是:连接好装置,从水准管注水,左右两边出现稳定的液面差,说明气
密性良好。使用冷水冷凝的目的是:使水蒸气液化(或除去水蒸气),选取的仪器应该接近药品的体积,所以选用100ml, 氮气的质量为="0.0672" mL*1.25 g/L=0.084克
2NaN3 → 3N2
130 84
0.14*X克 0.084克
列比例式得:130:0.14*X克=84:0.084克 解得X=92.9%。