题目内容
【题目】请回答有关溶液的相关问题。
(研究一):NaCl和KNO3的溶解度曲线如图所示。
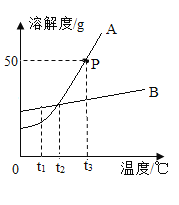
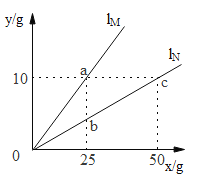
(1)图中表示NaC1溶解度曲线的是_______(选填“A”或“B”)。图中P点的意义是______________。
(2)将t1℃时NaCl和KNO3的饱和溶液升温到t2℃,所得溶液中溶质质量分数的关系是:NaCl_______KNO3(透填“>”、“=”或“<”)。
(研究二):配制80g溶质的质量分数为5%的氯化钠溶液(如图所示)
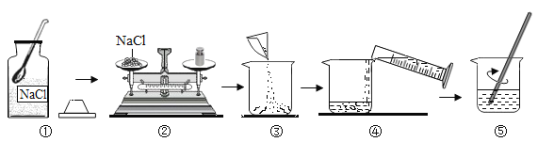
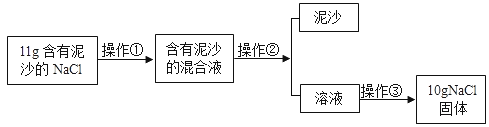
(1)实验中需要称量氯化钠的质量为________g。量取所需要的水选择_______mL(选填“10”“50”或“100”)量筒。
(2)步骤⑤中玻璃棒的作用是_____________。
(3)若在量取水的体积时俯视读数,则所配溶液中氯化钠的质量分数________5%(选填“>”“=”或“<”)。
【答案】B t3℃时,A的溶解度是50g > 4g 100 搅拌,加快氯化钠溶解速率 >
【解析】
[研究一](1)氯化钠的溶解度随温度改变大小变化不明显,所以表示NaCl的溶解度曲线是B图象;据图可知,P点的意义是:t3℃时,A的溶解度是50g;
(2)将t1℃时NaCl和KNO3的饱和溶液,均升温到t2℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以所得NaCl溶液的溶质质量分数等于KNO3溶液的溶质质量分数;
[研究二](1)配得溶液中含氯化钠的质量为80g×5%=4g;需要水的质量=80g-4g=76g,即76mL,所以应选择100mL量筒;
(2)步骤⑤是溶解氯化钠,玻璃棒的作用是搅拌,加快氯化钠溶解速率;
(3)若量取水时俯视读数,会导致量取的水的体积偏小,则所配溶液的溶质质量分数>5%。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目