题目内容
某化学研究小组进行研究性学习,请你协助完成相关任务.【研究课题1】探究水壶内部水垢的主要成分
【查阅资料】(1)天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢(主要成分为碳酸盐和碱).天然水和水垢所含的物质及其溶解性如下表:
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3[来源:] |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
【设计方案】
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置.取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无______(填化学式).
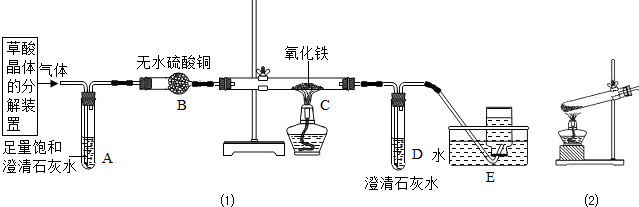
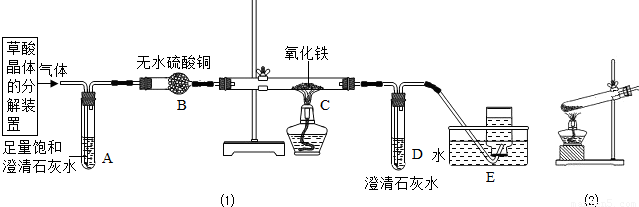
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分.

其主要实验步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸.
②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气,使装置内的气体缓缓通过后面的装置.
③称量D瓶内物质增加的质量;
④重复②和③的操作,直至D瓶内物质质量不变.
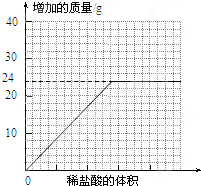
测量滴加稀盐酸体积与D瓶内物质增加质量的关系如图曲线所示;

【思考与评价】
(1)当水中含较多可溶性钙、镁化合物的水叫硬水,生活中降低水的硬度的常用方法是:______.
(2)A瓶中的NaOH溶液作用是______.
(3)若50g水垢全部是碳酸钙,则最终应该产生二氧化碳的质量是______g.
(4)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多.分析曲线图可知:水垢中一定含有______(化学式),理由是______.
(5)以上实验______(填“能够”或“不能”)检测出水垢中含有Mg(OH)2.
【研究课题2】为测定氯化钠样品的纯度,取30g氯化钠样品(杂质为氯化钙)溶于水配制成263g溶液,再加入53g溶质质量分数为20%的碳酸钠溶液,恰好完全反应.求:反应后所得溶液中溶质的质量分数.
【答案】分析:【提出猜想】根据物质的溶解性,对水垢的成分进行猜想;
【设计方案】(1)根据氢氧化钙的性质能和碳酸钠反应生成碳酸钙沉淀判断现象;
【思考与评价】(1)根据生活中降低水的硬度的常用方法是煮沸进行解答;
(2)根据实验目A瓶中的NaOH溶液作用是吸收空气中的二氧化碳进行解答;
(3)根据碳酸钙质量求出二氧化碳的质量;
(4)根据水垢中只有碳酸钙时只生二氧化碳质量是22g,实际生成CO2的质量是24g,大于22g进行解答;
(5)根据此实验没有涉及到氢氧化镁的检验进行解答;
【研究课题2】:根据碳酸钠的质量求出氯化钙的质量、生成氯化钠的质量以及原混合物中氯化钠的质量进而求出所得溶液中溶质的质量分数进行解答.
解答:解:【提出猜想】由物质的溶解性,水垢的主要成分一定含有Mg(OH)2和CaCO3,可能含有Ca(OH)2和MgCO3;
【设计方案】(1)氢氧化钙能和碳酸钠反应生成碳酸钙沉淀,取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无Ca(OH)2;
【思考与评价】(1)生活中降低水的硬度的常用方法是煮沸;
(2)实验目A瓶中的NaOH溶液作用是吸收空气中的二氧化碳;
(3)设产生二氧化碳的质量是x.
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
50g x

x=22g
答:产生二氧化碳的质量是22g.
(4)水垢中只有碳酸钙时只生二氧化碳质量是22g,实际生成CO2的质量是24g,大于22g,所以水垢中一定含有碳酸镁;
(5)此实验没有涉及到氢氧化镁的检验,以上实验不能检测出水垢中含有Mg(OH)2;
【研究课题2】:设生成碳酸钙的质量为x,生成氯化钠的质量为y,参加反应的氯化钙的质量为z.
CaCl2+Na2CO3 =CaCO3↓+2NaCl
111 106 100 117
z 53g×20% x y
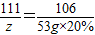
z=11.1g
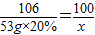
x=10g
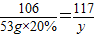
y=11.7g
30g氯化钠样品中氯化钠的质量=30g-11.1g=18.9g
所得溶液中溶质的质量分数=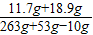 ×100%=10%.
×100%=10%.
故答案为:【提出猜想】CaCO3;【设计方案】(1)Ca(OH)2;
【思考与评价】(1)煮 沸;(2)吸收空气中的二氧化碳;(3)22g;
(4)MgCO3;水垢中只有碳酸钙时只生二氧化碳质量是22g,实际生成CO2的质量是24g,大于22g,所以水垢中一定含有碳酸镁;
(5)不能;
【研究课题2】:10%.
点评:本题涉及基础知识的仪器识别、装置气密性的检查,还涉及较为复杂的数据分析,难度跨度很大,在解答时要谨慎处理.
【设计方案】(1)根据氢氧化钙的性质能和碳酸钠反应生成碳酸钙沉淀判断现象;
【思考与评价】(1)根据生活中降低水的硬度的常用方法是煮沸进行解答;
(2)根据实验目A瓶中的NaOH溶液作用是吸收空气中的二氧化碳进行解答;
(3)根据碳酸钙质量求出二氧化碳的质量;
(4)根据水垢中只有碳酸钙时只生二氧化碳质量是22g,实际生成CO2的质量是24g,大于22g进行解答;
(5)根据此实验没有涉及到氢氧化镁的检验进行解答;
【研究课题2】:根据碳酸钠的质量求出氯化钙的质量、生成氯化钠的质量以及原混合物中氯化钠的质量进而求出所得溶液中溶质的质量分数进行解答.
解答:解:【提出猜想】由物质的溶解性,水垢的主要成分一定含有Mg(OH)2和CaCO3,可能含有Ca(OH)2和MgCO3;
【设计方案】(1)氢氧化钙能和碳酸钠反应生成碳酸钙沉淀,取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无Ca(OH)2;
【思考与评价】(1)生活中降低水的硬度的常用方法是煮沸;
(2)实验目A瓶中的NaOH溶液作用是吸收空气中的二氧化碳;
(3)设产生二氧化碳的质量是x.
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
50g x

x=22g
答:产生二氧化碳的质量是22g.
(4)水垢中只有碳酸钙时只生二氧化碳质量是22g,实际生成CO2的质量是24g,大于22g,所以水垢中一定含有碳酸镁;
(5)此实验没有涉及到氢氧化镁的检验,以上实验不能检测出水垢中含有Mg(OH)2;
【研究课题2】:设生成碳酸钙的质量为x,生成氯化钠的质量为y,参加反应的氯化钙的质量为z.
CaCl2+Na2CO3 =CaCO3↓+2NaCl
111 106 100 117
z 53g×20% x y
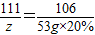
z=11.1g
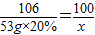
x=10g
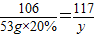
y=11.7g
30g氯化钠样品中氯化钠的质量=30g-11.1g=18.9g
所得溶液中溶质的质量分数=
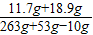 ×100%=10%.
×100%=10%.故答案为:【提出猜想】CaCO3;【设计方案】(1)Ca(OH)2;
【思考与评价】(1)煮 沸;(2)吸收空气中的二氧化碳;(3)22g;
(4)MgCO3;水垢中只有碳酸钙时只生二氧化碳质量是22g,实际生成CO2的质量是24g,大于22g,所以水垢中一定含有碳酸镁;
(5)不能;
【研究课题2】:10%.
点评:本题涉及基础知识的仪器识别、装置气密性的检查,还涉及较为复杂的数据分析,难度跨度很大,在解答时要谨慎处理.

练习册系列答案
相关题目