题目内容
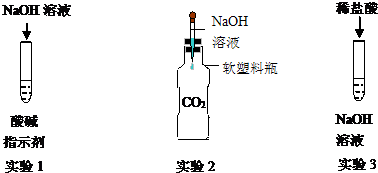
某化学兴趣小组为探究氢氧化钠的化学性质,做了如下图所示的3个实验.试回答下列问题:
(1)实验1:实验结束后观察到试管中溶液呈红色,由此推断,该试管中的指示剂是无色酚酞溶液.
(2)实验2:氢氧化钠和二氧化碳反应时本没有明显现象,该兴趣小组利用如实验2的装置后就可以观察到明显现象从而证明反应的发生.
①写出实验过程中会观察到的现象是
②该兴趣小组发现用其他方法也可证明反应的发生:取反应后的溶液,向其中加入
(3)实验3:当该兴趣小组加入过量的稀盐酸后,依然没有观察到明显的现象,他们由此判定氢氧化钠和盐酸不反应.你认为他们的判断是否正确.若不正确,你认为他们的实验可以怎么改进从而可以判断反应是否发生.
(4)某地一辆满载浓硫酸的罐车翻到,导致50t质量分数为98%的浓硫酸泄露,接到报警后的消防官兵赶来后立即用熟石灰处理.若要完全中和泄露的浓硫酸,理论上需要熟石灰多少吨?

(1)实验1:实验结束后观察到试管中溶液呈红色,由此推断,该试管中的指示剂是无色酚酞溶液.
(2)实验2:氢氧化钠和二氧化碳反应时本没有明显现象,该兴趣小组利用如实验2的装置后就可以观察到明显现象从而证明反应的发生.
①写出实验过程中会观察到的现象是
塑料瓶变瘪
塑料瓶变瘪
,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O
CO2+2NaOH═Na2CO3+H2O
多余
多余
,该反应不是
不是
(填“是”或“不是”)复分解反应.②该兴趣小组发现用其他方法也可证明反应的发生:取反应后的溶液,向其中加入
稀盐酸
稀盐酸
,其现象是有气泡冒出
有气泡冒出
,写出该反应的化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑
Na2CO3+2HCl═2NaCl+H2O+CO2↑
.(3)实验3:当该兴趣小组加入过量的稀盐酸后,依然没有观察到明显的现象,他们由此判定氢氧化钠和盐酸不反应.你认为他们的判断是否正确.若不正确,你认为他们的实验可以怎么改进从而可以判断反应是否发生.
(4)某地一辆满载浓硫酸的罐车翻到,导致50t质量分数为98%的浓硫酸泄露,接到报警后的消防官兵赶来后立即用熟石灰处理.若要完全中和泄露的浓硫酸,理论上需要熟石灰多少吨?
分析:(1)实验1:无色酚酞溶液遇碱性溶液变红色.
(2)实验2:氢氧化钠和二氧化碳反应时本没有明显现象,该兴趣小组利用如实验2的装置后就可以观察到明显现象从而证明反应的发生.
①利用氢氧化钠溶液与二氧化碳反应,正确书写化学方程式,判定复分解反应.
②利用碳酸钠溶液与稀盐酸反应,正确写出该反应的化学方程式.
(3)实验3:当该兴趣小组加入过量的稀盐酸后,依然没有观察到明显的现象,需要加入指示剂;
(4)稀释前后的硫酸溶液中,硫酸的质量是不变的,所以,中和掉的硫酸就是50吨98%的浓硫酸中的硫酸;根据反应的化学方程式,由硫酸的质量计算氢氧化钙的质量.一定量的硫酸分别与氢氧化钙粉末、氧化钙粉末、碳酸钙粉末完全反应后,经过化学方程式的计算得出氢氧化钙粉末、氧化钙粉末、碳酸钙粉所消耗的质量关系如何.
(2)实验2:氢氧化钠和二氧化碳反应时本没有明显现象,该兴趣小组利用如实验2的装置后就可以观察到明显现象从而证明反应的发生.
①利用氢氧化钠溶液与二氧化碳反应,正确书写化学方程式,判定复分解反应.
②利用碳酸钠溶液与稀盐酸反应,正确写出该反应的化学方程式.
(3)实验3:当该兴趣小组加入过量的稀盐酸后,依然没有观察到明显的现象,需要加入指示剂;
(4)稀释前后的硫酸溶液中,硫酸的质量是不变的,所以,中和掉的硫酸就是50吨98%的浓硫酸中的硫酸;根据反应的化学方程式,由硫酸的质量计算氢氧化钙的质量.一定量的硫酸分别与氢氧化钙粉末、氧化钙粉末、碳酸钙粉末完全反应后,经过化学方程式的计算得出氢氧化钙粉末、氧化钙粉末、碳酸钙粉所消耗的质量关系如何.
解答:解:(1)实验1:实验结束后观察到试管中溶液呈红色,由此推断,该试管中的指示剂是无色酚酞溶液.
(2)实验2:氢氧化钠和二氧化碳反应时本没有明显现象,该兴趣小组利用如实验2的装置后就可以观察到明显现象从而证明反应的发生.
①利用氢氧化钠溶液与二氧化碳反应,写出实验过程中会观察到的现象是 塑料瓶变瘪,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O,该反应 不是复分解反应.
②利用碳酸钠溶液与稀盐酸反应:取反应后的溶液,向其中加入 稀盐酸,其现象是 有气泡冒出,写出该反应的化学方程式 Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)实验3:当该兴趣小组加入过量的稀盐酸后,依然没有观察到明显的现象,他们由此判定氢氧化钠和盐酸不反应.他们的判断不正确,可以先在氢氧化钠溶液中滴加无色酚酞溶液再加入稀盐酸;
(4)设理论上需要氢氧化钙的质量为x
Ca(OH)2+H2SO4═CaSO4+2H2O
74 98
x 50t×98%=49t
=
解之得:x=37t
答:中和泄漏的硫酸,理论上需要约37吨氢氧化钙.
(2)实验2:氢氧化钠和二氧化碳反应时本没有明显现象,该兴趣小组利用如实验2的装置后就可以观察到明显现象从而证明反应的发生.
①利用氢氧化钠溶液与二氧化碳反应,写出实验过程中会观察到的现象是 塑料瓶变瘪,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O,该反应 不是复分解反应.
②利用碳酸钠溶液与稀盐酸反应:取反应后的溶液,向其中加入 稀盐酸,其现象是 有气泡冒出,写出该反应的化学方程式 Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)实验3:当该兴趣小组加入过量的稀盐酸后,依然没有观察到明显的现象,他们由此判定氢氧化钠和盐酸不反应.他们的判断不正确,可以先在氢氧化钠溶液中滴加无色酚酞溶液再加入稀盐酸;
(4)设理论上需要氢氧化钙的质量为x
Ca(OH)2+H2SO4═CaSO4+2H2O
74 98
x 50t×98%=49t
| 74 |
| x |
| 98 |
| 49t |
答:中和泄漏的硫酸,理论上需要约37吨氢氧化钙.
点评:本题考查学生化学方程式与溶液的溶质质量分数的综合计算,计算过程较为简单,此题能锻炼学生的良好思维及解题能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
某固体样品中除了含有在高温下不分解,也不与空气成分反应的物质外,还可能含有CaCO3、CaO中的一种或两种.某化学兴趣小组为探究该固体的成分,称量样品m1g,经高温充分煅烧并在干燥的保护气中冷却,至质量不再减轻为止,剩余固体的质量为m2g.下列推断不正确的是( )
| A、若m1=m2,则原样品中无CaCO3 | ||
| B、若m2<m1,则原样品中一定有CaCO3 | ||
C、若
| ||
D、若
|
 (2010?青岛)某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中就是均已打磨,且形状、大小相同;所用盐酸的溶质质量分数、用量也相同).下列判断中,错误的是( )
(2010?青岛)某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中就是均已打磨,且形状、大小相同;所用盐酸的溶质质量分数、用量也相同).下列判断中,错误的是( )
