题目内容
【题目】下列三套装置都能用于实验室制取二氧化碳
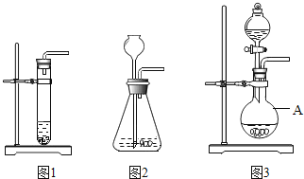
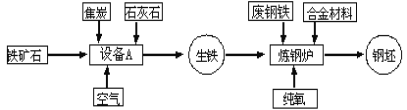
(1)写出实验室制取二氧化碳的化学方程式:____________________,
(2)仪器A的名称是__________________
(3)利用图2装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是_____________,
(4)图1和图3装置相比.利用图1装置来制取二氧化碳,时主要的不足是_______(写一条即可)
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶 于水).充分反应后经过过滤、千操等操作,最后称量,数据如下表
稀盐酸的用量 | 剩余固体的质量 |
第一次加入5g | 1.5g |
第二次加入59 | 1.0g |
第三次加入59 | 0.5g |
第四次加入59 | 0.3g |
①石灰石样品中碳酸钙的质量分数为_________________
②原稀盐酸中溶质的质量分数为多少?(写出计其过程)
【答案】(1)CaCO3+2HCl==CaCl2+H2O+CO2↑ (2)烧瓶;(3)防止产生的气体从长颈漏斗中逸出;(4)不能控制反应的发生和停止;(5)①85%; ②7.3%
【解析】
试题分析:此题是一道实验探究和化学计算的综合题,通过图示可知,制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是防止产生的气体从长颈漏斗中逸出;图5和图7装置相比.利用图5装置来制取二氧化碳,时主要的不足是不能控制反应的发生和停止;通过表格分析可知,5g的盐酸能反应掉碳酸钙0.5g,所以原来的石灰石是2g,杂质是0.3g,所以碳酸钙的质量分数为:1.7g/2g×100%=85%,第一次反应消耗碳酸钙0.5g,据此代入方程式计算即可。
(1)CaCO3+2HCl==CaCl2+H2O+CO2↑ (2)烧瓶;(3)防止产生的气体从长颈漏斗中逸出;(4)不能控制反应的发生和停止;(5)①85%;
②设第一次反应中消耗氯化氢的质量为x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73
0.5g x
100/73=0.5g/x
X=0.365g
原稀盐酸中溶质的质量分数为:0.365g/5g×100%=7.3%