题目内容
碳酸钙可用作补钙剂,以工业大理石(主要杂志是氧化铁)为原料提纯碳酸钙的流程如下: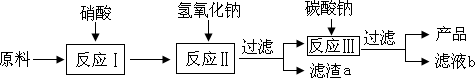
回答下列问题:
(1)为加快反应I中的固体溶解,可采取的措施有________(只写一点).
(2)写出反应Ⅱ中有沉淀生成的反应化学方程式________.
(3)若将滤液b中的溶质回收再用,除了得到NaNO3外,还可能得到________(填化学式);其中NaNO3可用于补充植物养分,它属于化肥中的________肥.
(4)反应Ⅰ中不选用稀硫酸的原因是________.
解:(1)加快反应I中的固体溶解,可采取的措施有:把工业大理石研成粉末、搅拌等;故答案为:把工业大理石研成粉末
(2)反应Ⅱ中有沉淀生成的反应化学反应是,硝酸铁和氢氧化钠反应生成氢氧化铁红褐色沉淀和硝酸钠,配平即可;故答案为:Fe(NO3)3+3NaOH=Fe(OH)3↓+3NaNO3
(3)将滤液b中的溶质回收再用,除了得到NaNO3外,还可能得到反应Ⅱ中加入的氢氧化钠,反应Ⅲ中加入的碳酸钠;NaNO3中含有氮元素属于氮肥.故答案为:NaOH、Na2CO3;氮
(4)反应Ⅰ中不选用稀硫酸的原因是:碳酸钙与稀硫酸反应生成的硫酸钙微溶于水,故答案为:碳酸钙与稀硫酸反应生成的硫酸钙微溶于水
分析:加快反应I中的固体溶解,可采取的措施有:把工业大理石研成粉末、搅拌等;根据题目给出的流程图和信息:反应Ⅱ中有沉淀生成的反应化学反应是,硝酸铁和氢氧化钠反应生成氢氧化铁红褐色沉淀和硝酸钠,配平即可;将滤液b中的溶质回收再用,除了得到NaNO3外,还可能得到反应Ⅱ中加入的氢氧化钠,反应Ⅲ中加入的碳酸钠;NaNO3中含有氮元素属于氮肥.反应Ⅰ中不选用稀硫酸的原因是:碳酸钙与稀硫酸反应生成的硫酸钙微溶于水.
点评:本考点属于物质的分离和提纯,还考查了混合物的分离方法,是中考的重点也是一个难点.本题利用流程图中的现象和实验方案的设计,考查同学们的判断能力,同学们只要认真分析,根据条件综合把握,问题就会迎刃而解.本考点主要出现在实验题中.
(2)反应Ⅱ中有沉淀生成的反应化学反应是,硝酸铁和氢氧化钠反应生成氢氧化铁红褐色沉淀和硝酸钠,配平即可;故答案为:Fe(NO3)3+3NaOH=Fe(OH)3↓+3NaNO3
(3)将滤液b中的溶质回收再用,除了得到NaNO3外,还可能得到反应Ⅱ中加入的氢氧化钠,反应Ⅲ中加入的碳酸钠;NaNO3中含有氮元素属于氮肥.故答案为:NaOH、Na2CO3;氮
(4)反应Ⅰ中不选用稀硫酸的原因是:碳酸钙与稀硫酸反应生成的硫酸钙微溶于水,故答案为:碳酸钙与稀硫酸反应生成的硫酸钙微溶于水
分析:加快反应I中的固体溶解,可采取的措施有:把工业大理石研成粉末、搅拌等;根据题目给出的流程图和信息:反应Ⅱ中有沉淀生成的反应化学反应是,硝酸铁和氢氧化钠反应生成氢氧化铁红褐色沉淀和硝酸钠,配平即可;将滤液b中的溶质回收再用,除了得到NaNO3外,还可能得到反应Ⅱ中加入的氢氧化钠,反应Ⅲ中加入的碳酸钠;NaNO3中含有氮元素属于氮肥.反应Ⅰ中不选用稀硫酸的原因是:碳酸钙与稀硫酸反应生成的硫酸钙微溶于水.
点评:本考点属于物质的分离和提纯,还考查了混合物的分离方法,是中考的重点也是一个难点.本题利用流程图中的现象和实验方案的设计,考查同学们的判断能力,同学们只要认真分析,根据条件综合把握,问题就会迎刃而解.本考点主要出现在实验题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目