题目内容
取只含有少量氯化钠杂质的粉末状Na2CO3样品11.4g于烧杯中,逐滴加入稀盐酸至不再产生气体为止,共消耗稀盐酸的质量为50g,反应后称得烧杯中溶液的质量为57g(假定反应产生的二氧化碳全部逸出,水蒸气挥发忽略不计).
请分析回答下列问题:
(1)放出二氧化碳的质量为________g.
(2)稀盐酸的溶质质量分数为多少?
(3)计算反应后所得溶液中溶质的质量分数(精确到0.1%)
解:(1)由质量守恒定律可知,生成的二氧化碳的质量为:11.4g+50g-57g=4.4g;
(2)设参加反应的稀盐酸的溶质质量的为x,碳酸钠的质量为y,反应后生成的氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
y x z 4.4g
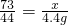 x=7.3g
x=7.3g
 y=10.6g
y=10.6g
 z=11.7g
z=11.7g
稀盐酸的溶质质量分数为: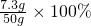 =14.6%;
=14.6%;
(3)反应后所得溶液中溶质的质量分数为: =21.9%..
=21.9%..
答:(1)放出二氧化碳的质量为 4.4g;(2)稀盐酸的溶质质量分数为14.6%,(3)反应后所得溶液中溶质的质量分数为21.9%.
分析:(1)根据质量守恒定律,反应前后烧杯中物质减少的质量为二氧化碳的质量.
(2)根据碳酸钠与盐酸反应的方程式,由二氧化碳的质量求出稀盐酸的溶质的质量,再根据溶质的质量分数的计算公式,求出稀盐酸的溶质质量分数;
(3)根据碳酸钠与盐酸反应的方程式,由二氧化碳的质量求出生成的氯化钠的质量,在计算所得溶液中溶质的质量分数时,要注意溶液中的溶质包括原混合物就有的,还有生成的.
点评:本题主要考查了学生解决有关含杂质物质的化学方程式的计算能力,解题关键是根据质量守恒定律首先求出二氧化碳的质量,再求出溶液中的溶质的质量,解题时既要考虑生成的物质,又要考虑原混合物就有的物质.
(2)设参加反应的稀盐酸的溶质质量的为x,碳酸钠的质量为y,反应后生成的氯化钠的质量为z
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
y x z 4.4g
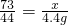 x=7.3g
x=7.3g y=10.6g
y=10.6g z=11.7g
z=11.7g稀盐酸的溶质质量分数为:
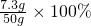 =14.6%;
=14.6%;(3)反应后所得溶液中溶质的质量分数为:
 =21.9%..
=21.9%..答:(1)放出二氧化碳的质量为 4.4g;(2)稀盐酸的溶质质量分数为14.6%,(3)反应后所得溶液中溶质的质量分数为21.9%.
分析:(1)根据质量守恒定律,反应前后烧杯中物质减少的质量为二氧化碳的质量.
(2)根据碳酸钠与盐酸反应的方程式,由二氧化碳的质量求出稀盐酸的溶质的质量,再根据溶质的质量分数的计算公式,求出稀盐酸的溶质质量分数;
(3)根据碳酸钠与盐酸反应的方程式,由二氧化碳的质量求出生成的氯化钠的质量,在计算所得溶液中溶质的质量分数时,要注意溶液中的溶质包括原混合物就有的,还有生成的.
点评:本题主要考查了学生解决有关含杂质物质的化学方程式的计算能力,解题关键是根据质量守恒定律首先求出二氧化碳的质量,再求出溶液中的溶质的质量,解题时既要考虑生成的物质,又要考虑原混合物就有的物质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目