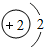题目内容
物质的结构决定物质的性质.已知氢元素原子的核电荷数为1.试分析:
(1)H+是结构最简单的一种阳离子,H+中含有的质子数为________,电子数为________.
(2)CaH2是一种离子化合物,其中Ca元素的化合价为+2,则该化合物中氢元素的化合价为________.已知反应物中具有还原性的物质,发生氧化反应后,有元素化合价升高.请判断CaH2+2H2O=Ca(OH)2+2H2↑反应中,反应物________(填化学式)具有还原性.
质子数=核电荷数=核外电子数,所以H+中含有的质子数为1,电子数为 0;
故答案为:1;0;
(2)根据根据在化合物中正负化合价代数和为零,CaH2中Ca元素的化合价为+2,则该化合物中氢元素的化合价为:(+2)+2x=0;则x=-1;
根据题中信息:反应物中具有还原性的物质,发生氧化反应后,有元素化合价升高;
在CaH2+2H2O=Ca(OH)2+2H2↑反应中,CaH2中氢元素的化合价由反应前-1价,到反应后0价,化合价升高;所以说反应物CaH2 具有还原性;
故答案为:-1;CaH2 .
分析:(1)根据 H+的含义进行解答;
(2)根据根据在化合物中正负化合价代数和为零,进行解答;
根据题中信息:反应物中具有还原性的物质,发生氧化反应后,有元素化合价升高;进行分析解答.
点评:本题考查学生对离子的含义的理解,及根据题意中信息进行分析解题的能力.

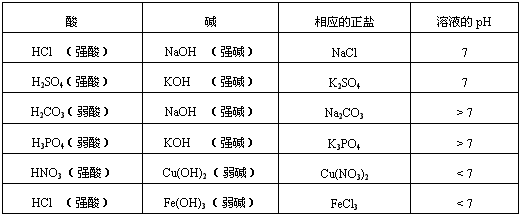
某课外兴趣小组,确立了“酸碱中和生成的正盐溶液的性质”作为研究课题,在研究中他们发现,正盐虽然不能电离出氢离子或氢氧根离子,但是其溶液却不一定呈中性,有的是酸性,有的呈碱性。为什么呢?盐溶液的酸碱性与什么有关呢?由“组成、结构决定物质性质”的观点出发,他们又进一步从组成特征上去找原因,发现正盐溶液的酸碱性与对应的酸和碱的强弱有关。他们将实验结果统计如下:
| 酸 | 碱 | 相应的正盐 | 溶液的pH |
| HCl(强酸) | NaOH (强碱) | NaCl | 7 |
| H2SO4(强酸) | KOH(强碱) | K2SO4 | 7 |
| H2CO3(弱酸) | NaOH(强碱) | Na2CO3 | >7 |
| H3PO4(弱酸) | KOH(强碱) | K3PO4 | >7 |
| HNO3(强酸) | Cu(OH)2(弱碱) | Cu(NO3)2 | <7 |
| HCl(强酸) | Fe(OH)3(弱碱) | FeCl3 | <7 |
(1)请你根据上表归纳出正盐溶液的酸碱性与对应酸、碱的强弱关系;
(2)根据他们的发现,请你判断硝酸钠、硝酸铁、硫酸铜、氯化钾、磷酸钠、碳酸钾六种溶液的酸碱性,其中溶液呈酸性的是 、呈碱性的是 、呈中性的是 。
某课外兴趣小组,确立了“酸碱中和生成的正盐溶液的性质”作为研究课题,在研究中他们发现,正盐虽然不能电离出氢离子或氢氧根离子,但是其溶液却不一定呈中性,有的呈酸性,有的呈碱性。为什么呢?盐溶液的酸碱性与什么有关呢?由“组成、结构决定物质性质”的观点出发,他们又进一步从组成特征上去找原因, 发现正盐溶液的酸碱性与对应的酸和碱的强弱有关。他们将实验结果统计如下:
| 酸 | 碱 | 相应的正盐 | 溶液的pH |
| HCl (强酸) | NaOH (强碱) | NaCl | 7 |
| H2SO4(强酸) | KOH (强碱) | K2SO4 | 7 |
| H2CO3(弱酸) | NaOH (强碱) | Na2CO3 | > 7 |
| H3PO4(弱酸) | KOH (强碱) | K3PO4 | > 7 |
| HNO3 (强酸) | Cu(OH)2 (弱碱) | Cu(NO3)2 | < 7 |
| HCl (强酸) | Fe(OH)3 (弱碱) | FeCl3 | < 7 |
⑴ 请你根据上表归纳出正盐溶液的酸碱性与对应酸、碱的强弱关系: 强酸和强碱生成的正盐溶液呈中性;强碱与弱酸生成的正盐溶液呈碱性;强酸与弱碱生成的正盐溶液呈酸性 。
⑵ 根据他们的发现,请你判断硝酸钠、硝酸铁、硫酸铜、氯化钾、磷酸钠、碳酸钾六种溶液的酸碱性,其中溶液呈酸性的是 、呈碱性的是 、呈中性的是 。
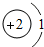 D.原子结构示意图为
D.原子结构示意图为