题目内容
【题目】现有含杂质的氯化镁样品10g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到117g质量分数为10%的溶液.求:
(1)样品中氯化镁的质量分数;
(2)所加入氢氧化钠溶液的质量分数(计算结果精确到0.1%).
【答案】
(1)解:117g质量分数为10%的溶液中氯化钠的质量是:117g×10%=11.7g
设样品中氯化镁的质量为x,消耗氢氧化钠的质量为y
MgCl2+ | 2NaOH═Mg(OH)2↓+ | 2NaCl |
95 | 80 | 117 |
x | y | 11.7g |
![]() =
= ![]() x=9.5g
x=9.5g
![]() =
= ![]() y=8g
y=8g
样品中氯化镁的质量分数是 ![]() ×100%=95%
×100%=95%
(2)解:据质量守恒定律可知氢氧化镁的质量是:9.5g+8g﹣11.7g=5.8g
氢氧化钠溶液的质量=117g+5.8g﹣9.5g=113.3g
则加入的氢氧化钠溶液中溶质的质量分数为:
![]() ×100%=7.1%
×100%=7.1%
【解析】氯化镁和氢氧化钠恰好反应生成氢氧化镁沉淀和氯化钠,所得滤液是氯化钠溶液,10%的溶液117g 中溶质氯化钠的质量是:117g×10%=11.7g,由方程式算出氯化镁的质量,进而求出其质量分数;根据氯化钠的质量算出氢氧化钠的质量,再除以氢氧化钠溶液的质量,氢氧化钠溶液的质量可据质量守恒定律求解.

练习册系列答案
相关题目
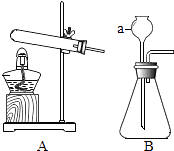
【题目】根据下列实验装置图,回答问题.
发生装置 | 收集装置 | 洗气装置 |
|
|
|
(1)写出图中仪器a的名称: .
(2)实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为 , 可选择的发生装置为(填字母).
(3)实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式为 , 该反应生成的二氧化碳气体中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置除去氯化氢气体,则该混合气体应从F装置的(填“①”或“②”)通入.