题目内容
(2008?枣庄)过氧化钠(Na2O2)是一种淡黄色固体,有两个实验小组的同学为探究其与二氧化碳的反应,都用下图所示的装置进行实验.一段时间后,将带余赆的木条插入试管中,木条复燃.
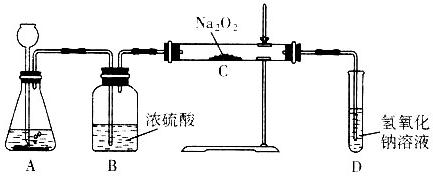
请回答下列问题:
(1)A是制取CO2的装置,写出A中发生反应的化学方程式:
(2)第1小组同学认为Na2O2与CO2反应生成了Na2CO3和O2,该反应的化学方程式为:
(3)第2小组同学认为除生成Na2CO3和O2外,还有可能生成NaHCO3,你认为呢?并简述原因
(4)请设计一种实验方案证明Na2O2与CO2反应生成了Na2CO3

请回答下列问题:
(1)A是制取CO2的装置,写出A中发生反应的化学方程式:
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.(2)第1小组同学认为Na2O2与CO2反应生成了Na2CO3和O2,该反应的化学方程式为:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
.(3)第2小组同学认为除生成Na2CO3和O2外,还有可能生成NaHCO3,你认为呢?并简述原因
不可能.根据质量守恒定律,反应物中没有氢元素,故不可能生成NaHCO3
不可能.根据质量守恒定律,反应物中没有氢元素,故不可能生成NaHCO3
.(4)请设计一种实验方案证明Na2O2与CO2反应生成了Na2CO3
取反应后生成的固体,加稀盐酸,生成使澄清石灰水变浑浊的气体
取反应后生成的固体,加稀盐酸,生成使澄清石灰水变浑浊的气体
.分析:(1)实验室利用碳酸钙与盐酸可以发生复分解反应生成氯化钙、水和二氧化碳的性质,制取二氧化碳;
(2)根据插入试管的带余烬木条复燃,可判断反应生成了氧气;根据质量守恒定律可推断,过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(3)根据质量守恒定律,反应前后元素的种类不变,所以,推断生成碳酸氢钠是不符合反应事实的;
(4)碳酸盐都可以与稀盐酸反应放出二氧化碳,能与稀盐酸反应放出二氧化碳的都属于碳酸盐.
(2)根据插入试管的带余烬木条复燃,可判断反应生成了氧气;根据质量守恒定律可推断,过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(3)根据质量守恒定律,反应前后元素的种类不变,所以,推断生成碳酸氢钠是不符合反应事实的;
(4)碳酸盐都可以与稀盐酸反应放出二氧化碳,能与稀盐酸反应放出二氧化碳的都属于碳酸盐.
解答:解:(1)实验室通常使用石灰石或大理石(主要成分都为碳酸钙)与稀盐酸反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳;
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)根据反应产生了能使带火星木条复燃的氧气,第一组同学认为,过氧化钠与二氧化碳反应生成碳酸钠和氧气;书写方程式时,由于反应物中有气体二氧化碳,生成物中产生的气体氧气不需再注明;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)碳酸氢钠由碳、氢、氧、钠四种元素组成,而反应物二氧化碳和过氧化钠中不含氢元素,根据质量守恒定律,反应生成碳酸氢钠的观点不正确;
故答案为:不可能.根据质量守恒定律,反应物中没有氢元素,故不可能生成NaHCO3;
(4)碳酸盐与稀盐酸反应可放出气体二氧化碳,因此,可取反应后的固体与稀盐酸反应,把产生的气体通入澄清石灰水,若石灰水变浑浊,可说明固体为碳酸盐;或者把反应后的固体溶于水,向所得溶液中滴加氯化钙,如产生白色沉淀,也可证明固体中含有碳酸根;
故答案为:取反应后生成的固体,加稀盐酸,生成使澄清石灰水变浑浊的气体(或取反应后生成的固体,加CaCl2溶液,生成白色沉淀或其他合理答案).
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)根据反应产生了能使带火星木条复燃的氧气,第一组同学认为,过氧化钠与二氧化碳反应生成碳酸钠和氧气;书写方程式时,由于反应物中有气体二氧化碳,生成物中产生的气体氧气不需再注明;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(3)碳酸氢钠由碳、氢、氧、钠四种元素组成,而反应物二氧化碳和过氧化钠中不含氢元素,根据质量守恒定律,反应生成碳酸氢钠的观点不正确;
故答案为:不可能.根据质量守恒定律,反应物中没有氢元素,故不可能生成NaHCO3;
(4)碳酸盐与稀盐酸反应可放出气体二氧化碳,因此,可取反应后的固体与稀盐酸反应,把产生的气体通入澄清石灰水,若石灰水变浑浊,可说明固体为碳酸盐;或者把反应后的固体溶于水,向所得溶液中滴加氯化钙,如产生白色沉淀,也可证明固体中含有碳酸根;
故答案为:取反应后生成的固体,加稀盐酸,生成使澄清石灰水变浑浊的气体(或取反应后生成的固体,加CaCl2溶液,生成白色沉淀或其他合理答案).
点评:任何化学变化都遵循质量守恒定律,即反应前后元素的种类不变;利用这一定律,可对参加反应的物质的组成进行猜测和判断.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
