题目内容
下列实验操作正确的是( )
A. 点燃酒精灯 B.
点燃酒精灯 B. 稀释浓硫酸
稀释浓硫酸
C.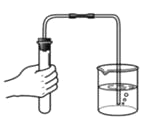 检查装置气密性 D.
检查装置气密性 D. 取用液体药品
取用液体药品
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
(提出问题)该样品中含有那些物质?
(提出猜想)通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为_____。
(查阅资料)
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
(实验探究1)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取少量样品溶于水,加入_____; | 白色沉淀产生 | 该反应的化学方程式_____; |
(2)将上述反应后的混合物过滤,取滤液加入_____。 | _____。 | 证明猜想Ⅱ正确 |
化学学习离不开化学变化,变化实现物质间的相互转化:
(1)Ca(OH)2变质
①请写出Ca(OH)2变质的原因______(用化学方程式表示)。
(2)定性研究Ca(OH)2变质程度
②请设计实验确定Ca(OH)2的变质程度,写出操作、现象及结论______。
(3)定量研究Ca(OH)2变质程度
③配制稀盐酸:计算配制300g质量分数为5%的盐酸,需要质量分数为30%的盐酸______g。
配制过程中,除烧杯、玻璃棒、量筒外,还需用到的玻璃仪器是______。若量取30%的盐酸时俯视读数,所配制的盐酸质量分数______5%(填大于、小于)。
④实验测定:称取40.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如表所示:
反应时间/min | 0 | t1 | t2 | t3 | t4 |
烧杯总质量/g | 150.0 | 147.8 | 145.6 | 145.6 | 145.6 |
请计算该样品中Ca(OH)2的质量分数。_____