题目内容
【题目】化学学习小组用金属镁进行实验探究.
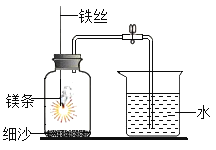
(1)甲同学利用如图装置进行空气里氧气含量的实验,待镁条燃烧完全并冷却后打开止水夹,发现进入集气瓶中水的体积约占集气瓶容积的70%.
①正常情况下,如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的_____.根据空气的组成同学们推出减少的气体为氧气和_____.
②下列是同学们对“测定空气里氧气的含量”实验的认识,其中错误的是_____(填选项字母代号)
A 装置不漏气是实验成功的重要因素之一 B 可燃物用量不足会影响实验结论
C 瓶内气压变小能将水吸入集气瓶内 D 燃烧结束后应立即进行测量
(2)乙同学将燃着的镁条插入盛有二氧化碳的集气瓶中,发现镁条继续燃烧,集气瓶壁上有黑色固体和白色固体产生,请写出该反应的化学方程式_____.分析实验(1)、(2),你对燃烧有了哪些新的认识?_____(写出一条即可)
(3)丙同学将镁条插入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,向滤渣中滴加稀盐酸,发现有气泡产生,则滤渣中一定含有_____,滤液中一定含有的金属离子是_____.
(4)丁同学将3.6g镁带放入100g稀硫酸中,正好完全反应,试计算该硫酸溶液的溶质质量分数._____
【答案】![]() 氮气 D
氮气 D ![]() 燃烧不一定需要氧气的参与 铜,锌 镁离子(符号也可) 14.7%
燃烧不一定需要氧气的参与 铜,锌 镁离子(符号也可) 14.7%
【解析】
(1)空气成分测定中已知氧气是占空气体积的五分之一,而用镁条做该实验测得的结果是70%,说明镁条和空气中的其他成分而其他成分中能达到如此比例的也只有氮气,所以可以推测应该是和氧气、氮气发生了反应;
(2)根据(1)(2)信息可推知燃烧不一定都需要氧气参与;
(3)涉及金属的活动性由强到弱的顺序镁、锌、铜,同时按照金属反应的优先原则,镁先和硝酸铜反应,待硝酸铜完全反应后才和硝酸锌反应,而滤渣滴加盐酸有气体,说明一定有生成的锌,还有可能同时存在剩余的镁,进而推测对应的离子;
(4)根据镁条的质量和对应的化学方程式求算对应的稀硫酸中溶质的质量,进而求算其质量分数。
(1)空气成分测定中已知氧气是占空气体积的五分之一,而用镁条做该实验测得的结果是70%,说明镁条和空气中的其他成分而其他成分中能达到如此比例的也只有氮气,所以可以推测应该是和氧气、氮气发生了反应;所以
①正常情况下,如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的![]() ,根据空气的组成同学们推出减少的气体为氧气和氮气。
,根据空气的组成同学们推出减少的气体为氧气和氮气。
②A、装置不漏气是实验成功的重要因素之一,这样才能保证水的等量代换,正确;
B、可燃物用量不足会影响实验结论,可燃物不足,会导致装置内的能消耗的气体不能被完全消耗,进而影响实验结论,正确;
C、该实验的原理就是利用瓶内气压变小能将水吸入集气瓶内,进而等量替代,正确;
D、由于该反应放热,而气体的体积收到温度的影响,所以实验结束后应该等装置恢复到室温打开止水夹进而读数,否则影响实验结果,错误;
故选:D。
(2)将燃着的镁条插入盛有二氧化碳的集气瓶中,发现镁条继续燃烧,集气瓶壁上有黑色固体和白色固体产生,根据质量守恒定律和物质的颜色状态可知,生成黑色物质为碳,白色固体为氧化镁,对应的化学方程式为![]() ,根据该反应以及(1)可以看出燃烧不一定需要氧气的参与。
,根据该反应以及(1)可以看出燃烧不一定需要氧气的参与。
(3)涉及金属的活动性由强到弱的顺序镁、锌、铜,同时按照金属反应的优先原则,镁先和硝酸铜反应,待硝酸铜完全反应后才和硝酸锌反应,而滤渣滴加盐酸有气体,说明一定有生成的锌,还有可能同时存在剩余的镁,所以滤渣中一定含有生成的铜和锌,可能含有剩余的镁,而滤液中一定存在金属离子是镁离子。
(4)设3.6g镁条完全反应消耗的稀硫酸中的溶质的质量为x,则
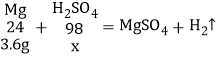
![]() ,x=14.7g;
,x=14.7g;
该硫酸溶液的溶质质量分数为![]() 。
。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案