题目内容
【题目】实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如图所示8个实验.
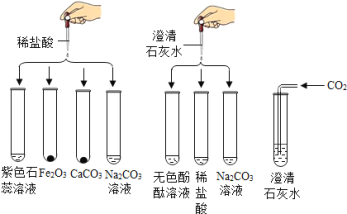
已知:Na2CO3+CaCl2═CaCO3↓+2NaCl
(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为 .
(2)实验后某试管中为红色溶液,向其中加入足量的 ,溶液变为无色.由此推断,该试管中最初盛有的物质是 .
(3)实验后某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.由此推断,该试管中最初发生反应的化学方程式为 ,原无色溶液中的溶质是 (写出一种可能即可).
【答案】(1)Fe2O3+6HCl═2FeCl3+3H2O(2)盐酸,无色酚酞试液
(3)Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaCl
【解析】(1)实验后某试管中为黄色溶液,说明是氧化铁和稀盐酸反应生成了氯化铁和水,则该试管中发生反应的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,
(2)实验后某试管中为红色溶液,向其中加入足量的某溶液后变为无色.说明原试管中盛有的是酚酞试液,加入的物质是盐酸,
(3)实验后某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.说明试管内的物质与碳酸钠不反应,由此推断,该试管中是碳酸钠和盐酸反应生成了氯化钠、水和二氧化碳,故最初发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,原无色溶液中的溶质是NaCl或是氯化钠和碳酸钠的混合物,

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目