题目内容
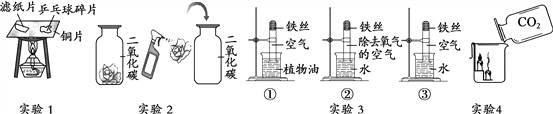
【题目】同学们利用如图所示的装置,对质量守恒定律进行了探究。实验结束后,老师另外提出了几个问题,请你一起参与思考。
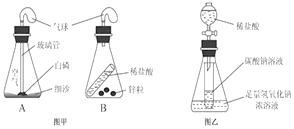
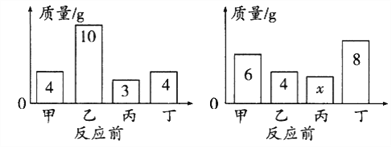
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是______(选填“A”、“B”或“A 和 B”)。
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是_________(选填序号)
①原稀盐酸的溶质质量分数
②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数
④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是__________?(若不能完全整除,计算结果保留0.1%)
【答案】 B ②④ ②
【解析】(1))图甲A中白磷燃烧,消耗氧气,无气体生成,装置内压强变小,气球变瘪,B中锌与稀盐酸反应生成氢气,装置内压强变大,气球胀大。(2)试管中滴入紫色石蕊试液变红,说明溶液显酸性,即反应时盐酸剩余,Na2CO3溶液完全反应。①原稀盐酸溶液剩余,不知道参加反应的稀盐酸的质量,无法求出原稀盐酸溶液的溶质质量分数,不符合题意;②NaOH浓溶液增加的质量是生成二氧化碳的质量,设碳酸钠溶液中碳酸钠的质量是y,
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
106 44
y 0.22g
![]() =
=![]() ,解得y= 0.53g
,解得y= 0.53g
原Na2CO3溶液的溶质质量分数为: ![]() ×100%=10.6%,符合题意;③因为是足量NaOH溶液,不知道参加反应的NaOH溶液质量是多少,无法求出NaOH溶液的溶质质量分数,不符合题意;④设反应后试管中NaCl的质量是x,
×100%=10.6%,符合题意;③因为是足量NaOH溶液,不知道参加反应的NaOH溶液质量是多少,无法求出NaOH溶液的溶质质量分数,不符合题意;④设反应后试管中NaCl的质量是x,
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
117 44
x 0.22g
![]() =
=![]() ,解得x=5.85g
,解得x=5.85g
反应后试管中溶液的质量为:5g+5g-0.22g=9.78g
反应后试管中NaCl的溶质质量分数为: ![]() ×100%=59.8%,符合题意。故选②④。
×100%=59.8%,符合题意。故选②④。

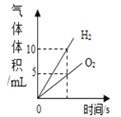
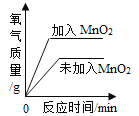
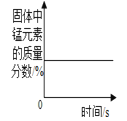
【题目】下列4个图像中,能正确反应变化关系的是( )
|
|
|
|
A.电解水生成气体的体积 | B.两份等体积5%的过氧化氢溶液,向其中一份加入少量二氧化锰 | C.加热一定质量的高锰酸钾固体 | D.在恒温条件下,将饱和的KNO3溶液蒸发适量水 |
A. A B. B C. C D. D
【题目】下表所示各组物质中,物质之间按箭头方向通过一步反应就能实现如下图所示转化的是( ) 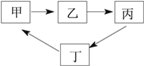
物质 选项 | 甲 | 乙 | 丙 | 丁 |
A | CO2 | CaCO3 | H2O | O2 |
B | KOH | KCl | CO2 | K2CO3 |
C | H2O2 | H2O | O2 | MgO |
D | CaO | Ca(OH)2 | H2O | CaCl2 |
A. A B. B C. C D. D