题目内容
【题目】某工厂产生的铜屑中含有少碎铁屑。现要回收利用其中的铜,需除去其中的铁屑,张山同学设计了甲、乙两个实验方案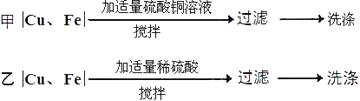
(1)以上两个实验方案中,从回收利用率角度考虑,你愿意选择。
(2)两个方案中都有过滤操作,该操作中必须用到的玻璃仪器有。
(3)写出两个实验方案中有关反应的化学方程式:
方案甲
方案乙
(4)请你再设计一个不同原理的方案。
【答案】
(1)方案甲
(2)漏斗、烧杯、玻璃棒
(3)Fe +CuSO4= FeSO4+Cu,Fe +H2SO4= FeSO4+ H2↑
(4)用磁铁吸
【解析】(1)由于铁和硫酸铜溶液反应时还会生成一部分铜,因此在甲方案中得到的铜要多一些;
(2)在过滤操作中一定会用到漏斗、烧杯、玻璃棒、铁架台、滤纸等;
(3)由于方案甲是铁和硫酸铜反应,而方案乙是铁和稀硫酸反应,反应的化学反应方程式为:Fe+CuSO4═FeSO4+Cu;Fe+H2SO4═FeSO4+H2↑;
(4)由于磁铁具有磁性,因此铁能被磁铁吸引,所以用磁铁吸引可以分离两者.
故答案为:(1)方案甲;(2)漏斗、烧杯、玻璃棒;(3)Fe +CuSO4= FeSO4+Cu;Fe +H2SO4= FeSO4+ H2↑;(4)用磁铁吸.
主要考查了对金属活动性顺序的应用,在金属活动性顺序中,位于氢前的金属能稀酸溶液反应生成氢气,位于前面的金属可以把排在它后面的金属从盐溶液中置换出来,由于铁既在铜前,也在氢前,所以铁既能和硫酸铜溶液反应也能和稀硫酸反应,从而可以达到除去铁的目的.

练习册系列答案
相关题目