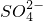题目内容
某氯化钾含有少量的氯化钡.现称取此固体混合物12.93克置于烧杯中,再逐步加入溶质质量分数为5%的K2SO4溶液34.80克,搅拌,恰好完全反应.在室温(20℃)下过滤,得滤液和滤渣.已知20℃时,KCl的溶解度为34.0克.求:(1)滤液的溶质质量分数;
(2)滤渣的质量.(计算结果保留两位小数.)
分析:根据题目中的反应物、生成物和反应条件,依据化学方程式的书写方法,可以写出氯化钡与K2SO4反应的化学方程式;根据化学方程式找出K2SO4溶与BaCl2、BaSO4、KCl的质量比,由K2SO4的质量可计算出BaCl2、BaSO4、KCl的质量.
(1)根据溶质质量分数公式:溶质质量分数=
×100%,来计算滤液的溶质质量分数;
(2)滤渣的质量=BaSO4的质量+未溶解的KCl的质量.
(1)根据溶质质量分数公式:溶质质量分数=
| 溶质质量 |
| 溶液质量 |
(2)滤渣的质量=BaSO4的质量+未溶解的KCl的质量.
解答:解:设固体混合物中含BaCl2质量为xg,则KCl质量为(12.93-x)g,BaCl2与K2SO4反应生成BaSO4质量为yg,生成KCl质量为zg.
BaCl2+K2SO4═BaSO4↓+2KCl
208 174 233 74.5×2
x克 34.80×5%g yg zg
则
=
,解得x=2.08,
=
,解得y=2.33;
=
,解得z=1.49;
但KCl总质量为(12.93-2.08)克+1.49克=12.34克
故知KCl未溶解完,余12.34克-11.24克=1.10克
故所得滤液为20℃时的饱和溶液
(1)滤液中溶质质量分数:
×100%=25.37%
(2)滤渣质量:2.33克+1.10克=3.43克
答:(1)滤液的溶质质量分数是25.37%;
(2)滤渣的质量是3.43克.
BaCl2+K2SO4═BaSO4↓+2KCl
208 174 233 74.5×2
x克 34.80×5%g yg zg
则
| 208 |
| xg |
| 174 |
| 34.80×5% |
| 233 |
| yg |
| 174 |
| 34.80×5% |
| 74.5×2 |
| zg |
| 174 |
| 34.80×5% |
但KCl总质量为(12.93-2.08)克+1.49克=12.34克
故知KCl未溶解完,余12.34克-11.24克=1.10克
故所得滤液为20℃时的饱和溶液
(1)滤液中溶质质量分数:
| 34g |
| 134g |
(2)滤渣质量:2.33克+1.10克=3.43克
答:(1)滤液的溶质质量分数是25.37%;
(2)滤渣的质量是3.43克.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算.在计算(2)时注意,滤渣的质量由两部分组成:氯化钡与硫酸钾反应生成的硫酸钡沉淀和为溶解的氯化钾的质量.

练习册系列答案
相关题目