题目内容
Cu、Fe、Zn、Al、Ag、Au(金)是生产生活中常用的金属.下面是某学习小组关于这几种金属的学习交流.请你参与交流并回答下列问题:
(1)食品包装中经常用到铝箔.铝能制成铝箔是因为铝具有良好的(填序号)______.
A.导电性 B.导热性 C.延展性 D.抗腐蚀性
(2)小明同学在对上述金属分类时,将“Au、Cu、Ag”划分为一类,你认为小明同学这样划分的依据是______.
(3)小红同学设计了如图所示的A、B两个实验(已将铁丝和银丝表面打磨).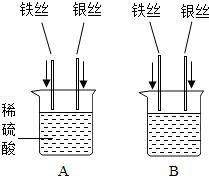
①A实验的目的是______.
②B实验中,当烧杯内盛有______溶液时,可验证Fe、Cu、Ag三种金属活动性强弱,有关的化学方程式为______.
(4)向铜粉和铁粉的混合物中加入一定量的盐酸,充分反应后过滤,以下判断不正确的是____________(填序号).
A.滤纸上可能没有铜 B.滤纸上可能没有铁 C.滤液中可能含有盐酸 D.滤液中可能含有氯化亚铁.
解:(1)铝能制成铝箔,表明金属铝具有良好的延展性;
故答案为:C;
(2)在Cu、Fe、Zn、Al、Ag、Au几种金属中,Au、Cu、Ag是不能置换酸中氢的不活泼金属,故可归为一类;
故答案为:活动性比氢弱(氢后金属);
(3)①可观察到铁能与稀硫酸反应放出气体,而银不能与稀硫酸反应;可说明两种金属的活动性强弱关系或是否能与酸发生反应;
故答案为:比较铁、银的金属活动性强弱(或金属是否与酸发生置换反应(产生氢气));
②要验证Fe、Cu、Ag三种金属活动性强弱,烧杯内应放入可溶性铜盐的溶液;利用铁能置换出铜而银不能,达到实验目的;若放入硫酸铜溶液时,
发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
故答案为:硫酸铜(氯化铜、硝酸铜);Fe+CuSO4═FeSO4+Cu;
(4)A、铜不能与稀盐酸反应,滤纸上的固体一定含有铜,故A的判断不正确;
B、铁能与盐酸反应,当酸不足铁有剩余时,滤纸上就会有铁;故B的判断正确;
C、当盐酸过量而有剩余时,滤液中则含有盐酸;故C的判断正确;
D、铁与盐酸反应生成的氯化亚铁溶解在溶液中,不能被过滤出来;故D的判断不正确;
故答案为:AD.
分析:(1)利用金属具有延展性,可把金属拉成丝压成片;
(2)根据金属活动性可把Cu、Fe、Zn、Al、Ag、Au分为活泼金属与不活泼金属两类;
(3)实验A可证明铁的活动性比银强;实验B,可放入铜盐的溶液,通过铁置换出铜而银不能,验证Fe、Cu、Ag三种金属活动性强弱;
(4)根据金属活动性,铜不能与稀盐酸反应,铁与稀盐酸反应形成浅绿色氯化亚铁溶液,同时放出氢气.
点评:金属活动性顺序表是金属化学性质的重要体现,是判断金属与其它物质能否发生反应的重要依据.
故答案为:C;
(2)在Cu、Fe、Zn、Al、Ag、Au几种金属中,Au、Cu、Ag是不能置换酸中氢的不活泼金属,故可归为一类;
故答案为:活动性比氢弱(氢后金属);
(3)①可观察到铁能与稀硫酸反应放出气体,而银不能与稀硫酸反应;可说明两种金属的活动性强弱关系或是否能与酸发生反应;
故答案为:比较铁、银的金属活动性强弱(或金属是否与酸发生置换反应(产生氢气));
②要验证Fe、Cu、Ag三种金属活动性强弱,烧杯内应放入可溶性铜盐的溶液;利用铁能置换出铜而银不能,达到实验目的;若放入硫酸铜溶液时,
发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
故答案为:硫酸铜(氯化铜、硝酸铜);Fe+CuSO4═FeSO4+Cu;
(4)A、铜不能与稀盐酸反应,滤纸上的固体一定含有铜,故A的判断不正确;
B、铁能与盐酸反应,当酸不足铁有剩余时,滤纸上就会有铁;故B的判断正确;
C、当盐酸过量而有剩余时,滤液中则含有盐酸;故C的判断正确;
D、铁与盐酸反应生成的氯化亚铁溶解在溶液中,不能被过滤出来;故D的判断不正确;
故答案为:AD.
分析:(1)利用金属具有延展性,可把金属拉成丝压成片;
(2)根据金属活动性可把Cu、Fe、Zn、Al、Ag、Au分为活泼金属与不活泼金属两类;
(3)实验A可证明铁的活动性比银强;实验B,可放入铜盐的溶液,通过铁置换出铜而银不能,验证Fe、Cu、Ag三种金属活动性强弱;
(4)根据金属活动性,铜不能与稀盐酸反应,铁与稀盐酸反应形成浅绿色氯化亚铁溶液,同时放出氢气.
点评:金属活动性顺序表是金属化学性质的重要体现,是判断金属与其它物质能否发生反应的重要依据.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
