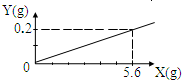题目内容
用某金属颗粒与足量稀盐酸反应,如生成氢气质量与所用金属质量之间关系如图,该金属颗粒可能是( )
A.纯净的锌
B.镁锌合金
C.纯净的铁
D.锌铜合金
【答案】分析:据图象可知生成0.2g氢气需要金属的质量是5.6g,可以根据选项提供的物质根据化学方程式进行计算即可得到结论.
解答:解:依据氢气的质量=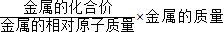 ,所以同质量的金属生成氢气的大小顺序是:镁>铁>锌;
,所以同质量的金属生成氢气的大小顺序是:镁>铁>锌;
A、设生成0.2g氢气需要金属锌的质量为x,
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.2g
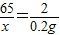
x=6.5g
故A错误;
B、设生成0.2g氢气需要金属镁的质量为z,
Mg+2HCl═MgCl2+H2↑
24 2
z 0.2g

x=2.4g
结合A的计算可知5.6g镁锌的混合物可以制得0.2g氢气;
C、设生成0.2g氢气需要金属铁的质量为y,
Fe+2HCl═FeCl2+H2↑
56 2
y 0.2g
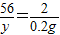
x=5.6g
所以纯铁适合;
D、根据A计算可以看出,产生0.2g氢气需要纯锌的质量是6.5g,铜不与酸反应生成氢气,则5.6g含铜的锌不可能生成0.2g氢气,故D错误;
故选BC
点评:此题是对金属与酸反应知识的考查,解题的关键是掌握同质量的金属生成氢气多少的比较,属于基础性化学计算题.
解答:解:依据氢气的质量=
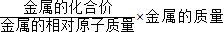 ,所以同质量的金属生成氢气的大小顺序是:镁>铁>锌;
,所以同质量的金属生成氢气的大小顺序是:镁>铁>锌;A、设生成0.2g氢气需要金属锌的质量为x,
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.2g
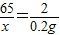
x=6.5g
故A错误;
B、设生成0.2g氢气需要金属镁的质量为z,
Mg+2HCl═MgCl2+H2↑
24 2
z 0.2g

x=2.4g
结合A的计算可知5.6g镁锌的混合物可以制得0.2g氢气;
C、设生成0.2g氢气需要金属铁的质量为y,
Fe+2HCl═FeCl2+H2↑
56 2
y 0.2g
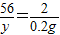
x=5.6g
所以纯铁适合;
D、根据A计算可以看出,产生0.2g氢气需要纯锌的质量是6.5g,铜不与酸反应生成氢气,则5.6g含铜的锌不可能生成0.2g氢气,故D错误;
故选BC
点评:此题是对金属与酸反应知识的考查,解题的关键是掌握同质量的金属生成氢气多少的比较,属于基础性化学计算题.

练习册系列答案
相关题目
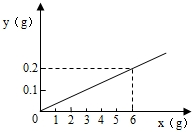 用某金属颗粒与足量的稀盐酸反应,如生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系如图,该金属颗粒可能是( )
用某金属颗粒与足量的稀盐酸反应,如生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系如图,该金属颗粒可能是( )| A、纯净的锌 | B、含铜的锌 | C、含有不与酸反应的杂质的铁 | D、含有不与酸反应的杂质的锌 |
 用某金属颗粒与足量稀盐酸反应,如生成氢气质量与所用金属质量之间关系如图,该金属颗粒可能是( )
用某金属颗粒与足量稀盐酸反应,如生成氢气质量与所用金属质量之间关系如图,该金属颗粒可能是( ) 用某金属颗粒与足量稀盐酸反应,如生成氢气质量与所用金属质量之间关系如图,该金属颗粒可能是
用某金属颗粒与足量稀盐酸反应,如生成氢气质量与所用金属质量之间关系如图,该金属颗粒可能是