题目内容
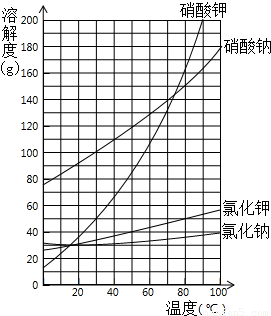
右图为NaNO3、KNO3、NaCl、和KCl 的溶解度曲线.请回答下面提出的问题:(1)工业上将NaNO3和KCl按100:87(质量比)溶于适量热水中.加热蒸发产生大量晶体.这些晶体是______;
(2)趁热过滤,并用少量热水淋洗晶体,淋洗所得溶液并入溶液中.淋洗的目的是______;
(3)边搅拌边冷却滤液,此时又析出大量晶体.过滤,并用少量水洗涤晶体.洗涤晶体时应用______水(填“热”或“冷”),洗涤的目的是______;
(4)第(3)步所得晶体经重结晶、干燥即得产品.该产品是______.
【答案】分析:利用电离理论结合溶液中的离子情况,分析会出现的物质,并对不同物质的溶解度受温度的影响的不同解决此题,根据过滤操作中的注意事项及每步操作的作用解答.
解答:解:(1)对混合液进行蒸发,此时温度较高,而在高温时NaCl的溶解较小,混合液中共含有Na+、NO3-、K+、Cl-,由于NaCl在高温时的溶解度最小,故溶液中的Na+、Cl-将首先结合为NaCl析出.
(2)过滤后用水淋洗晶体是洗去氯化钠表面的硝酸钾,从而减少硝酸钾的损失;
(3)硝酸钾的溶解度随温度升高而增大,故应用冷水洗涤,洗去表面的氯化物,提高硝酸钾的纯度.
(4)所得晶体是硝酸钾晶体
故答案为:(1)NaCl.(2)减少KNO3的损失.(3)在洗掉氯化物的同时,可提高KNO3的纯度;用冷水(4)KNO3
点评:结晶方法:蒸发溶剂结晶适用于溶解度受温度变化不大的物质,降温结晶适用于溶解度受温度影响较大的物质.
解答:解:(1)对混合液进行蒸发,此时温度较高,而在高温时NaCl的溶解较小,混合液中共含有Na+、NO3-、K+、Cl-,由于NaCl在高温时的溶解度最小,故溶液中的Na+、Cl-将首先结合为NaCl析出.
(2)过滤后用水淋洗晶体是洗去氯化钠表面的硝酸钾,从而减少硝酸钾的损失;
(3)硝酸钾的溶解度随温度升高而增大,故应用冷水洗涤,洗去表面的氯化物,提高硝酸钾的纯度.
(4)所得晶体是硝酸钾晶体
故答案为:(1)NaCl.(2)减少KNO3的损失.(3)在洗掉氯化物的同时,可提高KNO3的纯度;用冷水(4)KNO3
点评:结晶方法:蒸发溶剂结晶适用于溶解度受温度变化不大的物质,降温结晶适用于溶解度受温度影响较大的物质.

练习册系列答案
相关题目

 25、右图为NaNO3、KNO3、NaCl、和KCl 的溶解度曲线.请回答下面提出的问题:
25、右图为NaNO3、KNO3、NaCl、和KCl 的溶解度曲线.请回答下面提出的问题: 13、右图为元素周期表的一部分,下列有关说法中,错误的是( )
13、右图为元素周期表的一部分,下列有关说法中,错误的是( ) 右图为A、B、C三种物质的溶解度曲线,据图回答:
右图为A、B、C三种物质的溶解度曲线,据图回答: