题目内容
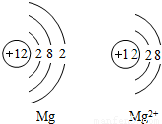
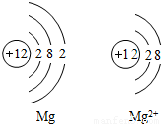
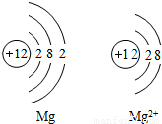
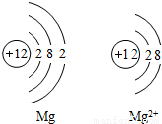
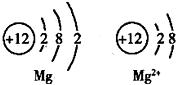 14、如图是Mg和Mg2+的结构示意图,回答下列问题.
14、如图是Mg和Mg2+的结构示意图,回答下列问题.(1)Mg和Mg2+属于同种元素,是因为
原子核内质子数相同(或它们具有相同的核电荷数)
.(2)它们的化学性质不同是因为
最外层电子数不同
,Mg2+(或镁离子)
具有相对稳定结构.分析:通过镁原子结构示意图和镁离子结构示意图的比较,很明显看出,小圈内的数字和符号相同(即核内质子数相同),所以它们是同种元素,又不管是什么原子,核电荷数=质子数=电子数=核电荷数;根据元素的最外层电子数决定其化学性质,那么它们的化学性质不同;由于最外层8个电子的结构叫做稳定结构,所以镁离子达到最佳稳态,而镁原子最外层2个电子不稳定.
解答:解:由于图示中它们核内质子数相同,所以是同种元素;它们最外层电子数不同,决定它们的化学性质不相同;而又稳定结构定义可知,镁离子最外层8电子,到达最佳稳态.
故正确答案:(1)原子核内质子数相同(或它们具有相同的核电荷数)
(2)最外层电子数不同;Mg2+(或镁离子)
故正确答案:(1)原子核内质子数相同(或它们具有相同的核电荷数)
(2)最外层电子数不同;Mg2+(或镁离子)
点评:本题以镁离子和镁原子结构示意图为例,考查对应该熟记的理论知识点的熟记情况,明确元素概念,化学性质的决定方法,稳定结构的定义.

练习册系列答案
相关题目