题目内容
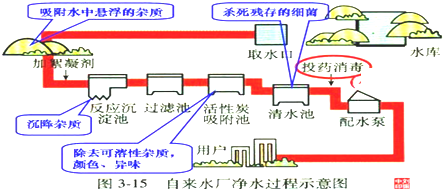
人类生活和工农业生产都离不开水,如图是自来水厂净化水的过程示意图.请根据图示回答下列问题:

(1)自来水厂生产自来水时,使用的净水方法有 (填序号).
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
(2)取水后加入絮凝剂(明矾)的作用是 .
(3)天然水中含有的可溶性杂质可能使水有气味或颜色,含有的不溶性杂质则使水浑浊.因此自来水厂常配有过滤池和活性炭吸附池.请你在上面图示中判断B处应是 池.
(4)ClO2或漂白粉[有效成分为[Ca(ClO)2]都可用于饮用水消毒.工业上制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2═X+Ca(ClO)2+2H2O,X的化学式为 .用漂白粉消毒后的自来水因含较多的Ca2+而成为硬水.生活中通过 可以降低水的硬度.肥皂遇到 水易起浮渣.
(5)节约用水人人有责,请举出一种节水的措施 .

(1)自来水厂生产自来水时,使用的净水方法有
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
(2)取水后加入絮凝剂(明矾)的作用是
(3)天然水中含有的可溶性杂质可能使水有气味或颜色,含有的不溶性杂质则使水浑浊.因此自来水厂常配有过滤池和活性炭吸附池.请你在上面图示中判断B处应是
(4)ClO2或漂白粉[有效成分为[Ca(ClO)2]都可用于饮用水消毒.工业上制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2═X+Ca(ClO)2+2H2O,X的化学式为
(5)节约用水人人有责,请举出一种节水的措施
分析:(1)根据自来水厂净化水的过程示意图,判断自来水厂生产水时,所使用的净水方法.
(2)根据明矾在净水过程中的作用解答;
(3)根据过滤是除去不溶性杂质,活性炭具有吸附作用,能够吸附水中的色素和异味进行解答;
(4)用肥皂水可以检验硬水和软水;要降低水的硬度,生活中可采用煮沸的方法.
(5)根据常见的节约用水的方法进行解答.
(2)根据明矾在净水过程中的作用解答;
(3)根据过滤是除去不溶性杂质,活性炭具有吸附作用,能够吸附水中的色素和异味进行解答;
(4)用肥皂水可以检验硬水和软水;要降低水的硬度,生活中可采用煮沸的方法.
(5)根据常见的节约用水的方法进行解答.
解答:解:(1)自来水厂生产水时,使用到的净水方法有:沉淀池中进行的沉淀,过滤池中进行的过滤,吸附池中进行的吸附,而没有煮沸和蒸馏;
(2)明矾溶于水后可以产生胶状物,吸附杂质,使杂质沉降;
(3)过滤是除去不溶性杂质,活性炭具有吸附作用,能够吸附水中的色素和异味,所以上面图示中A处是过滤池,B处是吸附池;
(4)化学反应前后原子的种类和数目不变和2Cl2+2Ca(OH)2═X+Ca(ClO)2+2H2O可知,X的化学式为CaCl2;向水中加入肥皂水,如果产生大量的泡沫,说明是软水;如果不产生泡沫或产生的泡沫很少,说明是硬水.要降低水的硬度,生活中可采用煮沸的方法;
(4)节约用水应从每个人做起,可结合生活中的具体事例来说明如何节约用水,如一水多用等.
故答案为:(1)ABE;
(2)形成胶状物吸附不溶于水的杂质使它们沉降下来;
(3)吸附;
(4)CaCl2;煮沸;肥皂水;
(5)及时关闭水龙头、用淘米水浇花、农业浇灌改大水漫灌为喷灌等.
(2)明矾溶于水后可以产生胶状物,吸附杂质,使杂质沉降;
(3)过滤是除去不溶性杂质,活性炭具有吸附作用,能够吸附水中的色素和异味,所以上面图示中A处是过滤池,B处是吸附池;
(4)化学反应前后原子的种类和数目不变和2Cl2+2Ca(OH)2═X+Ca(ClO)2+2H2O可知,X的化学式为CaCl2;向水中加入肥皂水,如果产生大量的泡沫,说明是软水;如果不产生泡沫或产生的泡沫很少,说明是硬水.要降低水的硬度,生活中可采用煮沸的方法;
(4)节约用水应从每个人做起,可结合生活中的具体事例来说明如何节约用水,如一水多用等.
故答案为:(1)ABE;
(2)形成胶状物吸附不溶于水的杂质使它们沉降下来;
(3)吸附;
(4)CaCl2;煮沸;肥皂水;
(5)及时关闭水龙头、用淘米水浇花、农业浇灌改大水漫灌为喷灌等.
点评:本题考查了水的净化、节水、求物质的化学式等知识,了解相关知识是解答的关键.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 (2011?呼和浩特)人类生活和工农业生产都离不开水,右图是自来水厂净化水的过程示意图:
(2011?呼和浩特)人类生活和工农业生产都离不开水,右图是自来水厂净化水的过程示意图: