题目内容
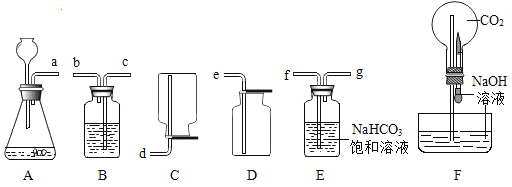
【题目】用氢气、木炭粉和一氧化碳还原氧化铜的实验,如图所示。
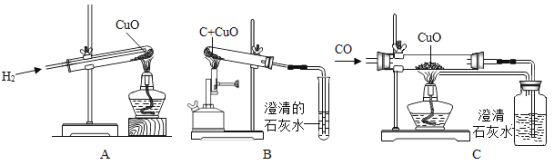
①上述实验都可观察到的现象是_______;A试管中反应的化学方程式为_____。
②A中试管敞口,C中玻璃管密闭的原因是_______。
③B、C中都能观察到石灰水变浑浊,反应的化学方程式为______。
④若B、C中等质量的氧化铜均完全反应,则石灰水(足量)中产生的沉淀质量是B_______C(选填“>”、“<”或“=”)。
【答案】黑色粉末变红色 ![]() 一氧化碳有毒,防止一氧化碳污染空气
一氧化碳有毒,防止一氧化碳污染空气 ![]() <
<
【解析】
氢气和氧化铜加热生成铜和水,碳和氧化铜高温生成铜和二氧化碳,一氧化碳和氧化铜加热生成铜和二氧化碳,二氧化碳和氢氧化钙反应生成碳酸钙和水。
①氢气和氧化铜加热生成铜和水,碳和氧化铜高温生成铜和二氧化碳,一氧化碳和氧化铜加热生成铜和二氧化碳,故上述实验都可观察到的现象是黑色粉末变红色;A试管中反应的化学方程式为![]() 。
。
②一氧化碳有毒,氢气无毒,故A中试管敞口,C中玻璃管密闭的原因是一氧化碳有毒,防止一氧化碳污染空气。
③B、C中都能观察到石灰水变浑浊,反应是二氧化碳和氢氧化钙生成碳酸钙和水,故反应的化学方程式为![]() 。
。
④B、C中反应的关系式分别为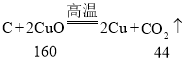 ,
,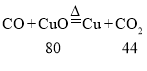 ,则B、C中等质量的氧化铜均完全反应,C中生成的二氧化碳较多,故石灰水(足量)中产生的沉淀质量是B<C。
,则B、C中等质量的氧化铜均完全反应,C中生成的二氧化碳较多,故石灰水(足量)中产生的沉淀质量是B<C。

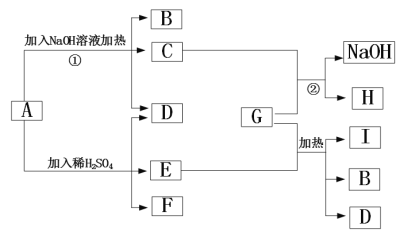
【题目】化学兴趣小组的同学在实验室发现一瓶保管不当,盛有无色溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na”字样。同学们很感兴趣,决定对其成分进行探究。
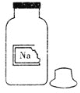
(提出问题)这瓶试剂可能是什么溶液呢?
(交流讨论)根据受损标签的情况判断,这瓶试剂不可能是_____(填字母)。
A酸 B碱 C盐
(作出猜想)
(1)可能是Na2CO3溶液;
(2)可能是NaCl溶液;
(3)请你再作出一种猜想,猜想的物质与上面类别不同:可能是________溶液。
(设计并实验)
实验 | 实验操作 | 实验现象 | 实验结论和解释 |
Ⅰ | 取样于试管中,向其中滴加几滴无色酚酞试液。 | 无色溶液变红 | 该溶液不可能是NaCl溶液。 理由________。 |
Ⅱ | 另取样于另一只试管中,向其中 滴加足量的________。 | 产生大量的气泡 | 该溶液溶质为碳酸钠。 |
由此,同学们得出结论:该溶液是碳酸钠溶液。
老师指出该结论不严密。理由是:氢氧化钠溶液在空气中敞开放置,发生变质,能产生与实验Ⅰ和Ⅱ相同现象。老师提示,不需另取样,只要在实验Ⅰ后的试管中加入足量的_____溶液,若观察到红色溶液不褪色现象,即可说明该溶液中有氢氧化钠。
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液的溶质质量分数是实验②的一半
B.在实验④中再加入 50g水后,溶液的溶质质量分数为 15%
C.由表格中的数据可以确定 25℃时该物质的溶解度大小的范围是:20 g≤S<30g
D.实验②中温度由 25℃冷却到 10℃时,一定有固体析出
【题目】碳酸锂是一种重要的锂盐,广泛应用于锂离子电池生产中。工业上可以用锂辉石精矿(主要成分是Li2O、含有Al2O3、SiO2等杂质) 为原料制取高纯的碳酸锂。某校化学活动小组收集了碳酸锂的溶解度数据如表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
设计了制取碳酸锂的工艺流程(如图):
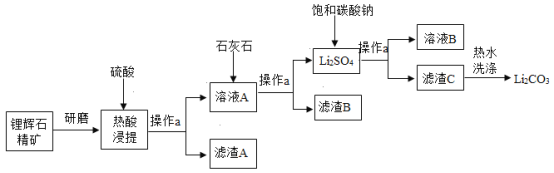
请回答:
(1)操作a所需的玻璃仪器有烧杯、玻璃棒和_____。
(2)热酸浸提中可能发生反应的化学方程式:
①_____;
②Li2O+H2SO4=Li2SO4+H2O。
(3)“洗涤”滤渣C时应该使用热水,其原因是_____。
(4)为了探究热酸浸提的最佳条件,将矿石在一定条件下酸浸4小时,测量锂元素浸出率的部分数据如表:
编号 | 矿酸比 | 硫酸浓度(%) | MgSO4用量(g) | 温度(℃) | 锂元素浸出率(%) |
1 | 1:1 | 90 | 0.00 | 100 | 70.34 |
2 | 1:1 | 98 | 0.00 | 100 | 73.89 |
3 | 1:1 | 98 | 0.00 | 150 | 78.24 |
4 | 1:3 | 98 | 0.00 | 200 | 85.53 |
5 | 1:3 | 98 | 1.25 | 250 | 90.26 |
6 | 1:3 | 98 | 2.50 | 250 | 95.88 |
①对比分析编号1和编号2的实验数据,可以得到的结论是_____。
②有同学想在实验6的基础上,从降低成本角度继续研究提高锂元素的浸出率,下面设计合理的是_____。
A 矿酸比1:2,硫酸浓度98%,MgSO4用量0.00,温度150℃
B 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度200℃
C 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度250℃
D 矿酸比1:3,硫酸浓度98%,MgSO4用量2.00,温度250℃