题目内容
【题目】图甲是A、B、C三种固体物质的溶解度曲线.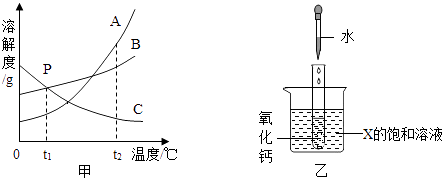
(1)甲图中,t1℃时,P点表示 .
(2)t2℃时A、B、C三种物质饱和溶液的溶质质量分数由大到小的顺序是 .
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小块生石灰,再加入5mL水,试管内发生的反应方程式为 , 几分钟后烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的(填写物质编号).
【答案】
(1)BC溶解度相等
(2)A>B>C
(3)CaO+H2O═Ca(OH)2,C
【解析】解:(1)由溶解度曲线可知:P点所表示的含义为:在t1℃时,B、C的溶解度相等;(2)饱和时质量分数的计算式 ![]() ×100%,即溶解度大则溶质的质量分数大;而t2℃时A、B、C三种物质的溶解度由大到小的顺序是:A>B>C,则饱和溶液中溶质的质量分数由大到小的顺序是:A>B>C;(3)生石灰和水反应生成氢氧化钙,反应方程式是:CaO+H2O═Ca(OH)2,反应放热,使溶液的温度升高,烧杯中出现浑浊,说明该物质的溶解度随温度升高而减小,因此X是C物质;
×100%,即溶解度大则溶质的质量分数大;而t2℃时A、B、C三种物质的溶解度由大到小的顺序是:A>B>C,则饱和溶液中溶质的质量分数由大到小的顺序是:A>B>C;(3)生石灰和水反应生成氢氧化钙,反应方程式是:CaO+H2O═Ca(OH)2,反应放热,使溶液的温度升高,烧杯中出现浑浊,说明该物质的溶解度随温度升高而减小,因此X是C物质;
所以答案是:(1)BC溶解度相等; (2)A>B>C;(3)CaO+H2O═Ca(OH)2;C.
【考点精析】根据题目的已知条件,利用固体溶解度曲线及其作用和溶质的质量分数、溶解性和溶解度的关系的相关知识可以得到问题的答案,需要掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和);溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1).

 阅读快车系列答案
阅读快车系列答案