题目内容
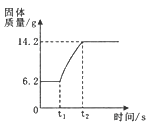
【题目】下列图像分别与选项中的操作相对应,其中可能合理的是

A.向一定量的稀盐酸和CaCl2混合溶液中滴入Na2CO3 溶液
B.向一定量的MnO2固体中加入一定量的过氧化氢溶液
C.向一定量的稀盐酸中滴入NaOH溶液
D.一定温度时,t ℃时,向一定量的饱和石灰水中加入生石灰
【答案】C
【解析】
试题分析:A.向CaCl2与盐酸的混合溶液中慢慢滴入Na2CO3溶液,Na2CO3首先与HCl反应放出气体二氧化碳,待完全反应后,继续与CaCl2反应生成碳酸钙沉淀,所以沉淀的生成不是从零刻度开始的,而是需要离开零刻度点.故A错误;B.在该反应中,二氧化锰是催化剂,反应的质量一直不变,故B错误;
C.一定量的盐酸中滴入NaOH,随着氢氧化钠的增多,溶液酸性逐渐减小,当盐酸反应完时,溶液就显碱性,故C正确;D.由于氧化钙能与水发生反应生成氢氧化钙,氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,溶液仍为饱和溶液,故D错误;故选C

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】实验员小周在学期末整理实验仪器时发现有一瓶标签模糊的溶液,如下图。

请你和小周一起探究该溶液的成分,并测定其质量分数。
第一步:猜想并验证该溶液的溶质是什么。
猜想:根据标签可知,这瓶溶液可能是HCl、KCl、NaCl等含有氯离子的酸或盐。
验证:
步骤 | 现象 | 结论 |
取样,滴加紫色石蕊 | 溶液变成_______色 | 这瓶溶液是盐酸 |
第二步:测定该溶液的溶质质量分数
实验原理:⑴用已知浓度的氢氧化钠溶液和盐酸反应,反应的化学方程式为:______________
⑵当盐酸和氢氧化钠恰好完全反应时,再增加一滴氢氧化钠溶液,溶液就呈碱性(可以使无色酚酞变成红色),而一滴氢氧化钠溶液的体积约为0.05ml,对测定结果的影响很小可忽略不计。
实验步骤:⑴取未知浓度的盐酸20g倒入烧杯中,向其中滴加2滴无色酚酞溶液。此时溶液呈_____色。
(2)量取质量分数1%的氢氧化钠溶液50ml(密度近似为1.0g/ml),用胶头滴管逐滴滴加该氢氧化钠溶液到盐酸中,观察到_______________,停止滴加,剩余氢氧化钠溶液的10ml。
实验反思:小周在做实验的时盛放待测盐酸的烧杯(实验步骤中加点的烧杯)在装入盐酸前内壁附着较多水,用该烧杯完成上述实验会导致结果_______(填“偏大”“偏小”或“无影响”)。
数据处理:计算该盐酸溶液的溶质质量分数_______________。
【题目】下列归类正确的是
选项 | 归类 | 物质(或元素) |
A | 常见碱 | 纯碱、烧碱、熟石灰 |
B | 常见合金 | 生铁、铜绿、硬铝 |
C | 常见干燥剂 | 浓硫酸、生石灰、碱石灰 |
D | 人体中常见微量元素 | 碘、锌、硒、钙等 |
A. A B. B C. C D. D