题目内容
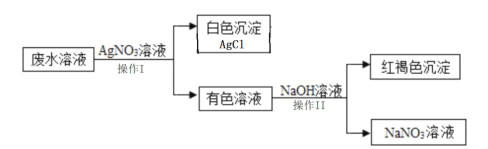
向AgNO3、Cu(NO3)2的混合溶液中投入一些锌粉,完全反应后过滤,得到滤渣和滤液:向滤出的固体中加入少量稀硫酸,若无气泡产生,滤液中一定含有的溶质为______(填化学式);若滤液为蓝色,则滤液中一定含有的金属离子是______(填离子符号)
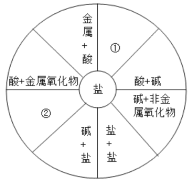
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和 他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式 是______。
(查阅资料)CaC12 滚液显中性
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分 是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想 I:只有 CaC12 猜想 II:有______
猜想 III:有 CaC12 和 Ca(OH)2 猜想 IV:有 CaCl2、HCl 和 Ca(OH)2 乙组同学对以上猜想提出质疑,认为猜想 IV 不合理,其理由是______。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
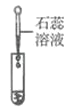
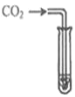
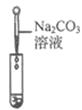
滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 | |
实验操作 |
|
|
|
实验现象 | _______ | _________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想 III 是正确的。
(评价反思)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有 Ca(OH)2,请你帮助他们说明原因______。
现将8.0g镁和铜的混合物粉末放入烧杯中,再将100.0g的稀硫酸分四次加入到该烧杯中,充分反应后,测得剩余固体质量的数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 25.0 | 25.0 | 25.0 | 25.0 |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4 |
(1)该混合物粉末中铜的质量分数为_____?
(2)所用稀硫酸中溶质的质量____?
下列各组实验方案中,不能达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 鉴别NaOH和NaCl两种固体 | 取样,加入少量水溶解,分别加入无色酚酞溶液 |
B | 除去CO2气体中的HCl | 将气体通过盛有足量NaOH溶液的洗气瓶 |
C | 鉴别化肥KNO3和NH4NO3 | 取样,加Ca(OH)2固体混合研磨,闻气味 |
D | 除去FeCl2溶液中的CuCl2 | 加入过量的Fe粉,充分反应后过滤 |
A.A B.B C.C D.D
某同学在实验室测定了几种溶液的pH,其结果如下表:
溶液 | 盐酸 | CuCl2溶液 | Na2SO4溶液 | 水 | Na2CO3溶液 | NaOH溶液 |
pH | 1 | 3 | 7 | 7 | 11 | 13 |
该同学由此得出的结论正确的是
A.碳酸钠溶液呈碱性,故属于碱 B.上述CuCl2溶液的酸性比盐酸强
C.盐溶液一定呈中性 D.利用酚酞能区分CuCl2溶液和NaOH溶液


 B.滴加液体
B.滴加液体
 D.倾倒液体
D.倾倒液体