题目内容
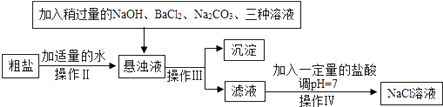
【题目】木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
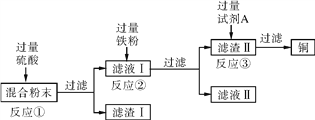
(1)写出下列反应的化学方程式:
反应①:____________________________________________;
反应②:____________________________________________。
(2)反应①所用的硫酸的质量分数为24.5%。现要配制40 g 24.5%的硫酸,需______g 98%的硫酸和______g水。实际操作时,用10 mL量筒取98%的硫酸(密度为1.84 g/cm3),请在图中表示出所取硫酸的体积_____。
![]()
(3)在进行“反应①”“反应②”“反应③” 的操作时,可将反应物加入________(填仪器名称)中,然后______________________(填操作),使反应充分进行。
(4)试剂A可选用__________(填化学式)溶液。
(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)______________________________________________________。
【答案】 H2SO4+CuO===CuSO4+H2O Fe+CuSO4===FeSO4+Cu 10 30 所取硫酸的体积为5.4 mL(如右图所示) ![]() 烧杯 用玻璃棒不断搅拌 H2SO4 回收滤渣Ⅰ中的Cu
烧杯 用玻璃棒不断搅拌 H2SO4 回收滤渣Ⅰ中的Cu
【解析】(1)稀硫酸与混合物中的铁和氧化铜反应,①:铁与稀硫酸反应生成硫酸亚铁和氢气,反应方程式为Fe+CuSO4===FeSO4+Cu;②氧化铜与稀硫酸反应生成硫酸铜和水,反应方程式为:H2SO4+CuO===CuSO4+H2O;
(2)配制40 g 24.5%的硫酸,需 98%的硫酸的质量为x ,![]() ,x=10g;需要加入水的质量为:40g-10g=30g;所取硫酸的体积为5.4 mL(如右图所示)
,x=10g;需要加入水的质量为:40g-10g=30g;所取硫酸的体积为5.4 mL(如右图所示) ![]() (3)烧杯可以做反应容器,故可以将反应物加入烧杯中,并用玻璃棒不断的搅拌,使反应充分进行;(4)反应2中过量的铁粉可以与溶液中的硫酸铜反应生成铁和铜,故滤渣2中的主要成分是铁和铜,由铁和铜的混合固体中分离出铜,故需要加入的试剂是硫酸,化学式为H2SO4;(5)滤渣1中液含有部分铜,故可以回收利用滤渣1中的铜;
(3)烧杯可以做反应容器,故可以将反应物加入烧杯中,并用玻璃棒不断的搅拌,使反应充分进行;(4)反应2中过量的铁粉可以与溶液中的硫酸铜反应生成铁和铜,故滤渣2中的主要成分是铁和铜,由铁和铜的混合固体中分离出铜,故需要加入的试剂是硫酸,化学式为H2SO4;(5)滤渣1中液含有部分铜,故可以回收利用滤渣1中的铜;

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】下表列举了法拉第《蜡烛的故事》中涉及的部分问题及对问题的回答,其中“对问题的回答”属于“设计实验方案”的是( )
选项 | 问题 | 对问题的回答 |
A | 火焰不同部位温度高低如何比较? | 用一火柴梗平放入火焰中,观察火柴梗不同部位的烧灼情况 |
B | 火焰为什么向上? | 热气流上升,形成对流 |
C | 火焰明亮的原因是什么? | 与火焰中的碳颗粒有关,碳颗粒会影响火焰明亮程度 |
D | 吹灭蜡烛时产生的白烟是什么? | 主要成分是石蜡蒸气凝结成的石蜡固体小颗粒 |
A.AB.BC.CD.D
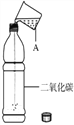
【题目】下图是开启后的碳酸饮料示意图,据图回答下列问题。

(1)饮料成分中属于氧化物的是__________(填序号)。
(2)开启后可以闻到香味,请用分子或原子的观点解释该现象__________。
(3)请选用一种方法探究饮料中溶解的二氧化碳,并将实验步骤和现象填在下表中:
实验步骤 | 实验现象 |
_________________ | _________________ |