题目内容
【题目】海洋资源十分丰富:
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的 Ba(OH)2 溶液;b.加入过量碳酸钠溶液;c.加入适量盐酸d.过滤;e.蒸发.正确的操作顺序是_____(填字母).加Na2CO3 溶 液的作用是除去_____.
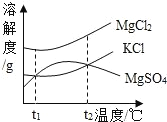
(2)晒盐后得到的卤水中含有 MgCl2、KCl 和 MgSO4 等物质,如图是它们的溶解度曲线示意图.设 t1℃时 MgCl2、KCl 和 MgSO4 三种物质的溶解度分别为 a、b、c, 则它们的大小关系为_____.
(3)目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是_______.
(4)海底矿产资源“可燃冰”的主要成分是水合甲烷晶体(CH4nH2O),若水合甲烷晶体中 CH4 的质量分数为 10%,则水合甲烷晶体的化学式为______ .甲烷燃烧的化学方程式是_______.
【答案】abdceCaCl2和过量的 Ba(OH)2 a>b=c 蒸干没有晶体析出 CH48H2O CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
【解析】
(1)可根据氯化钠溶解度与温度的关系进行分析选择结晶方法;根据除杂时不引入新杂质的原理及实验目的进行分析;(2)由MgCl2、KCl和MgSO4溶解度曲线示意图可知t1℃时MgCl2、KCl和MgSO4三种物质的溶解度大小;(3)海水淡化的方法主要有:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法,可根据原理进行分析;(4)根据题意,“可燃冰”,其主要成分是水合甲烷晶体(CH4nH2O),水合甲烷晶体中CH4的质量分数为10%,据此进行分析解答。
(1)要除去粗盐中含有的杂质,可以加过量的氢氧化钡溶液除去硫酸镁,加过量的Na2CO3溶液除去氯化钙和过量试剂氢氧化钡,通过过滤把不溶于水的物质除去,加适量的盐酸除去过量的碳酸钠,通过蒸发除去盐酸,故正确的操作顺序是abdce;加NaCO3溶液的作用是除去CaCl2和过量的Ba(OH)2;(2)由MgCl2、KCl和MgSO4溶解度曲线示意图可知t1℃时MgCl2、KCl和MgSO4三种物质的溶解度氯化镁最大,氯化钾等于硫酸镁,故a>b=c;(3)蒸馏水是纯净物,蒸干后不留任何痕迹,即蒸干后没有晶体析出;(4)由题意,“可燃冰”,其主要成分是水合甲烷晶体(CH4nH2O),水合甲烷晶体中CH4的质量分数为10%,则![]() ×100%=10%,n=8,则水合甲烷晶体的化学式为CH48H2O;甲烷燃烧的化学方程式为CH4+2O2
×100%=10%,n=8,则水合甲烷晶体的化学式为CH48H2O;甲烷燃烧的化学方程式为CH4+2O2 ![]() CO2+2H2O。
CO2+2H2O。