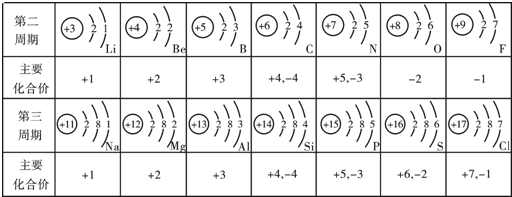
题目内容
生产生活中,钙元素和铁元素的存在非常广泛.
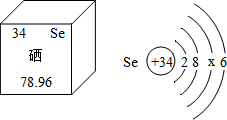
(1)在元素周期表中,钙元素的信息如图所示.钙元素的相对原子质量为______.
(2)次氯酸(HClO)具有杀菌消毒作用,制取HClO反应为:Ca(ClO)2+CO2+H2O═X+2HClO,则X的化学式为______,HClO中氯元素的化合价为______.
(3)清洁大理石地面,不能用“洁厕灵”(其有效成分为盐酸)的原因是______.(用化学方程式表示)
(4)某炼铁厂采用磁铁矿(主要成分为Fe3O4)和CO炼铁,试写出该反应的方程式______.

(1)在元素周期表中,钙元素的信息如图所示.钙元素的相对原子质量为______.
(2)次氯酸(HClO)具有杀菌消毒作用,制取HClO反应为:Ca(ClO)2+CO2+H2O═X+2HClO,则X的化学式为______,HClO中氯元素的化合价为______.
(3)清洁大理石地面,不能用“洁厕灵”(其有效成分为盐酸)的原因是______.(用化学方程式表示)
(4)某炼铁厂采用磁铁矿(主要成分为Fe3O4)和CO炼铁,试写出该反应的方程式______.

(1)根据元素周期表中的一个小格所提供的信息可知:钙元素一的相对原子质量为40.08;
答案为:40.80;
(2)根据质量守恒定律,化学反应前后元素种类不变和原子个数不变,从化学方程式Ca(ClO)2+CO2+H2O═X+2HClO看,反应物中有钙原子1个、氯原子2个、氧原子5个、碳原子1个、氢原子2个,生成物中有氢原子2个、氯原子2个、氧原子2个,因此X中含有1个钙原子、1个碳原子和3个氧原子,所以X的化学式是CaCO3;
根据在化合物中正负化合价代数和为零,氢元素显+1,氧元素显-2,设氯元素的化合价是x,可知次氯酸(HClO)中氯元素的化合价:(+1)+x+(-2)=0,则x=+1.
答案为:CaCO3;+1;
(3)因为“洁厕灵”主要成分为盐酸,大理石的主要成分是碳酸钙,碳酸钙能和盐酸(HCl)反应生成氯化钙、水和二氧化碳,
反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O.
(4)用磁铁矿(主要成分:Fe3O4)炼铁的化学反应原理是,4CO+Fe3O4
3Fe+4CO2;
答案:4CO+Fe3O4
3Fe+4CO2.
答案为:40.80;
(2)根据质量守恒定律,化学反应前后元素种类不变和原子个数不变,从化学方程式Ca(ClO)2+CO2+H2O═X+2HClO看,反应物中有钙原子1个、氯原子2个、氧原子5个、碳原子1个、氢原子2个,生成物中有氢原子2个、氯原子2个、氧原子2个,因此X中含有1个钙原子、1个碳原子和3个氧原子,所以X的化学式是CaCO3;
根据在化合物中正负化合价代数和为零,氢元素显+1,氧元素显-2,设氯元素的化合价是x,可知次氯酸(HClO)中氯元素的化合价:(+1)+x+(-2)=0,则x=+1.
答案为:CaCO3;+1;
(3)因为“洁厕灵”主要成分为盐酸,大理石的主要成分是碳酸钙,碳酸钙能和盐酸(HCl)反应生成氯化钙、水和二氧化碳,
反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O.
(4)用磁铁矿(主要成分:Fe3O4)炼铁的化学反应原理是,4CO+Fe3O4
| ||
答案:4CO+Fe3O4
| ||

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
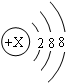 为某元素的原子结构示意图,该元素符号是______;
为某元素的原子结构示意图,该元素符号是______;
 --氢原子
--氢原子 --氧原子
--氧原子 --硫原子
--硫原子



 表示的是______(填离子符号);
表示的是______(填离子符号);