题目内容
【题目】某学习小组准备探究气体的测定和数据处理方法。
【提出问题】利用碳酸钙与稀盐酸反应来测定生成CO2的量。
【实验设计】通过下列两个实验分别测定CO2的质量和体积。
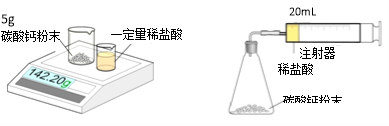
实验一 实验二
【分析处理】
实验一:
① 将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是 。
② 若稀盐酸足量,计算理论上能产生二氧化碳的物质的量 。(根据化学方程式进行计算)
实验二:
③ 先连接好装置,再 (填操作),然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中。若缓慢推入,则可能造成的后果是 。
④ 实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/mL | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
根据以上实验过程和数据综合分析,最终生成CO2的体积是 mL。
【反思与评价】
⑤ 经过分析,下列说法错误的是 。
A.实验一的操作简单,便于读数
B.实验一最终得到的数据和通过计算得出的理论值完全相等
C.实验二在密闭体系内反应,更环保
D.实验二中若将碳酸钙粉末改成块状的大理石,更安全
【答案】①最后一次加入稀盐酸后,电子天平上的示数不再发生变化(或“不再减小”或“没有气泡产生”)
②0.05mol
③检查装置气密性
锥形瓶内产生大量气体,压强变大,导致盐酸无法推入
④70 ⑤B
【解析】
试题分析:①碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,当没有气泡产生时说明反应已经完全;
②根据碳酸钙的质量,利用反应的化学方程式可计算出生成的二氧化碳的质量;
nCaCO3=5/100=0.05mol
设产生的二氧化碳为xmol
CaCO3+2HCl→CaCl2+ H2O+CO2↑
1/0.05 = 1/x
x=0.05mol
答:产生的二氧化碳为0.05mol。
③连接好装置后要先检查装置的气密性;碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,生成了气体会导致锥形瓶内的压强变大,故若缓慢推入会导致盐酸无法推入;
④由图可知注射器中的开始示数为20ml,最终示数为90ml,故生成的二氧化碳的体积为70ml;
⑤由于二氧化碳易溶于水,生成了二氧化碳部分会溶解在水中。

 名校课堂系列答案
名校课堂系列答案【题目】下表列出了除去物质中所含少量杂质的方法,其中错误的是
物质 | 杂质 | 除去杂质的方法 | |
A | CaO | CaCO3 | 加入足量的水溶解、过滤 |
B | NaOH溶液 | Na2CO3 | 加入过量的Ca(OH)2溶液,过滤 |
C | Cu(NO3)2溶液 | AgNO3 | 加入过量的铜粉,过滤 |
D | CO | CO2 | 通过NaOH浓溶液,干燥 |
【题目】下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 用浓硫酸在白纸上写字 | 白纸变黑甚至穿孔 | 浓硫酸有强烈的腐蚀性 |
B | 向稀盐酸中加入氢氧化钠溶液 | 无明显现象 | 二者之间不发生反应 |
C | 在装有过氧化氢溶液的试管中加入MnO2固体 | 有大量气泡产生 | MnO2是过氧化氢溶液 分解的催化剂 |
D | 向某溶液滴加BaCl2溶液,振荡 | 有白色沉淀生成 | 该溶液一定含有SO42- |
【题目】请根据下图回答问题:

① 将图1和图6连接可以制取氧气,反应的化学方程式为 ,证明氧气已经集满的现象是 。若用图6收集一瓶含1/4空气的氧气,操作的方法是 。
② 图2中仪器A的名称为 ,它在装置中的主要作用是 。甲同学用图2和图 连接来制取二氧化碳,装置中加入盐酸的量至少要 。
③ 乙同学在图2基础上增加了一块带孔的隔板(如图3),则大理石应放在 处(填“a”或“b”),该装置中加入盐酸的量至少要 ;若加入盐酸过多,则有可能产生的后果是 ,要使反应停止,其操作是 。
④ 丙同学用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为 。反应前他事先往试管中加入了少量的水,甲同学由此产生了疑问,提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓。
猜想2:……
甲同学根据猜想进行了实验:每次取15mL 15%的过氧化氢溶液,稀释成不同溶质
质量分数,在其他条件相同的情况下进行实验。记录数据如下:
实 验 | 1 | 2 | 3 | 4 | 5 |
过氧化氢溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% |
MnO2粉末用量/g | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
收集到500mL气体时所用时间/s | 560 | 186 | 103 | 35 | 12 |
反应后液体温度/℃ | 26 | 38 | 43 | 59 | 71 |
根据表中数据可知:过氧化氢溶液的溶质质量分数对反应速度的影响是 。
甲同学的猜想2是:加水可以 。