题目内容
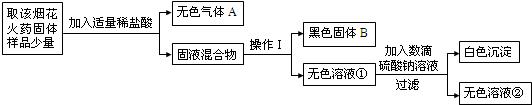
25、某固体样品中,可能含有Na2CO3、NaNO3、BaCl2、CuSO4中的一种或几种.将样品溶于水得到蓝色溶液,滴加BaCl2溶液后产生白色沉淀.过滤,向白色沉淀中加入足量的稀硝酸,沉淀不溶解.该固体中肯定存在
CuSO4
,肯定不存在Na2CO3和BaCl2
,可能有NaNO3
.分析:能够与BaCl2溶液产生白色沉淀的应该是碳酸盐或硫酸盐,过滤得到的白色沉淀不溶解于稀硝酸,说明该固体为硫酸钡,原溶液含有硫酸铜,一定无碳酸钠和氯化钡,可能含有硝酸钠.
解答:解:①由“将样品溶于水得到蓝色溶液”可知,该固体中肯定存在CuSO4(因为硫酸铜溶液呈蓝色);
②滴加BaCl2溶液后才产生白色沉淀,且白色沉淀不溶于稀硝酸,说明此白色沉淀为硫酸钡沉淀,原溶液中没有Na2CO3和BaCl2;
③因为NaNO3溶液无色,故该固体中可能有NaNO3.
故选CuSO4,Na2CO3和BaCl2,NaNO3.
②滴加BaCl2溶液后才产生白色沉淀,且白色沉淀不溶于稀硝酸,说明此白色沉淀为硫酸钡沉淀,原溶液中没有Na2CO3和BaCl2;
③因为NaNO3溶液无色,故该固体中可能有NaNO3.
故选CuSO4,Na2CO3和BaCl2,NaNO3.
点评:此题主要是考查学生的综合分析能力,不但要求学生具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.

练习册系列答案
相关题目
己知铁的氧化物有FeO、Fe2O3、Fe3O4,某固体样品由铁和氧两种元素组成,样品中铁与氧元素的质量比为
21:8,则下列关于该样品的组成的叙述中正确的是( )
21:8,则下列关于该样品的组成的叙述中正确的是( )
| A、该样品成分中一定含有Fe3O4 | B、若该样品含多种物质,则样品中一定含FeO | C、若该样品含多种物质,则样品中一定含Fe2O3 | D、该样品成分中不可能含有单质铁 |