题目内容
【题目】实验室有一包氯化钡和氯化钠的固体混合物32.5g,完全溶于141.2g水中,向其中逐滴加入碳酸钠溶液,反应过程中生成沉淀等质量与所加碳酸钠溶液质量的关系如图所示.计算:
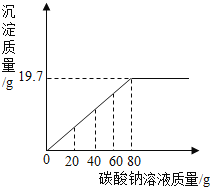
(1)所用碳酸钠溶液的溶质质量分数______;
(2)恰好完全反应时,所得溶液的溶质质量分数______.
【答案】13.25% 10%
【解析】
题目给出了生成的碳酸钡的质量,根据碳酸钡的质量和对应的化学方程式求算碳酸钠的质量、氯化钡的质量和生成的氯化钠的质量,进而求算所用碳酸钠溶液的溶质质量分数和所得溶液中溶质氯化钠的质量分数。
解:由图可以看出生成的碳酸钡的质量为19.7g,设参加反应的碳酸钠的质量为x,氯化钡的质量为y,生成氯化钠的质量为z,则:
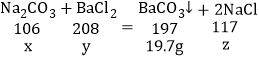
![]() x=10.6g,
x=10.6g,
![]() y=20.8g,
y=20.8g,
![]() z=11.7g,
z=11.7g,
所用碳酸钠溶液的溶质质量分数![]() ×100%=13.25%,
×100%=13.25%,
反应后溶液中NaCl的质量分数为:![]() ×100%=10% ,
×100%=10% ,
答:(1)所用碳酸钠溶液的溶质质量分数为13.25%;
(2)恰好完全反应时,所得溶液中溶质的质量分数是10%。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
【题目】清洁、高效的能源日益受到人们的重视。
(1)一氧化碳、氢气、甲烷三种气体可成为理想的燃料是____。
表1一定质量的燃料完全燃烧放出的热量
燃料 | 一氧化碳 | 氢气 | 甲烷 |
质量 | 28g | 2g | 16g |
热量(kJ) | 283.0 | 285.8 | 890.3 |
①写出一氧化碳燃烧的化学方程式________________。
②比较等质量表1中的燃料完全燃烧,放出热量最多的是_____。
(2)在红热的炭上洒少量水,炉火会烧得更旺,这是因为红热的炭能与水蒸气反应生成两种具有可燃性的气体,这两种气体是水煤气的主要成分。请写出该反应的化学方程式:____________。