题目内容
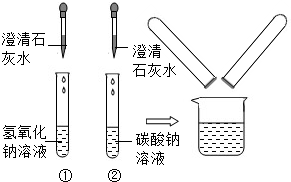
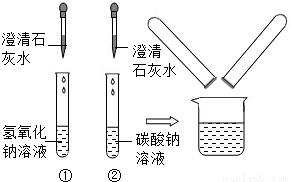
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验.(1)写出试管2中发生反应的化学方程式:
(2)实验结束后,小红同学将1、2两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
提出问题:滤液中除水外还含有哪些物质?
猜想:小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是 (写一种猜想).
【讨论】上述猜想中,你认为哪位同学中谁的猜想不合理,并说明理由.
【实验设计】设计一个简单的实验证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, . | 你的猜想正确 | |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
.
【答案】分析:根据题干提供的信息结合物质的性质进行分析,碳酸钠和氢氧化钠的水溶液都呈碱性,都能使酚酞试液变红,氢氧化钠与二氧化碳能反应生成碳酸钠,要检验氢氧化钠的变质程度,就是检验样品中是否含有氢氧化钠,而要检验氢氧化钠,需要除去碳酸钠且不能生成氢氧化钠,碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,据此解答即可.
解答:解:(1)氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(2)猜想:氢氧化钙和碳酸钠溶液反应时,存在物质过量的问题,可能是氢氧化钙过量,可能是氢氧化钠过量,由于反应生成氢氧化钠,故可能是氢氧化钙和氢氧化钠的混合物,故填:氢氧化钠和氢氧化钙;
讨论:由于氢氧化钙会与碳酸钠反应,故不会是氢氧化钙和碳酸钠同时剩余,故小明的猜想不合理,故填:小明猜想不合理,因为碳酸钠和氢氧化钙能发生反应,不能共存;
实验设计:要证明氢氧化钙存在,可以向样品中通入二氧化碳气体,如果试管中出现白色浑浊,说明是氢氧化钙和氢氧化钠的混合物,故填:通入二氧化碳气体,试管中出现白色浑浊;
反思拓展:在氢氧化钠存在的情况下,向样品中滴加几滴稀盐酸,盐酸的量太少,盐酸与氢氧化钠反应导致不会立即出现气泡,但是这时碳酸钠可能存在,故填:不正确,因为氢氧化钠存在,滴入几滴稀盐酸量太少,不会立即出现气泡,但碳酸钠有可能存在.
点评:本题考查了常见物质变质成分的探究,完成此题,可以依据物质的性质进行.要求同学们熟练掌握常见物质的性质,以便灵活应用.
解答:解:(1)氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(2)猜想:氢氧化钙和碳酸钠溶液反应时,存在物质过量的问题,可能是氢氧化钙过量,可能是氢氧化钠过量,由于反应生成氢氧化钠,故可能是氢氧化钙和氢氧化钠的混合物,故填:氢氧化钠和氢氧化钙;
讨论:由于氢氧化钙会与碳酸钠反应,故不会是氢氧化钙和碳酸钠同时剩余,故小明的猜想不合理,故填:小明猜想不合理,因为碳酸钠和氢氧化钙能发生反应,不能共存;
实验设计:要证明氢氧化钙存在,可以向样品中通入二氧化碳气体,如果试管中出现白色浑浊,说明是氢氧化钙和氢氧化钠的混合物,故填:通入二氧化碳气体,试管中出现白色浑浊;
反思拓展:在氢氧化钠存在的情况下,向样品中滴加几滴稀盐酸,盐酸的量太少,盐酸与氢氧化钠反应导致不会立即出现气泡,但是这时碳酸钠可能存在,故填:不正确,因为氢氧化钠存在,滴入几滴稀盐酸量太少,不会立即出现气泡,但碳酸钠有可能存在.
点评:本题考查了常见物质变质成分的探究,完成此题,可以依据物质的性质进行.要求同学们熟练掌握常见物质的性质,以便灵活应用.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
 (2011?泰安) 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如右图所示的实验.
(2011?泰安) 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如右图所示的实验.