题目内容
现有含杂质的氯化铜样品13.5克,加入足量的硝酸银溶液,可得到27克白色沉淀,则样品中可能含有的杂质是( )A.CaCl2
B.NaCl
C.MgCl2?10H2O
D.KCl
【答案】分析:假设13.5克样品全部都是CuCl2,根据方程式计算跟足量硝酸银反应生成氯化银的质量m
CuCl2+2AgNO3═2AgCl↓+Cu(NO3)2
135 287
13.5g m
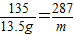 m=28.7g>27g
m=28.7g>27g
说明氯化铜不纯,应含有等质量时跟足量硝酸银完全反应生成沉淀氯化银的量小于27g的氯化物;
因此,需要比较选项中四种氯化物与硝酸银反应生成沉淀的量,进行判断.
解答:解:A、设13.5gCaCl2完全反应生成氯化银的质量为a
CaCl2~2AgCl
111 287
13.5g a
 a≈34.9g>27g;故不选A;
a≈34.9g>27g;故不选A;
B、设13.5gNaCl完全反应生成氯化银的质量为b
NaCl~AgCl
58.5 143.5
13.5g b
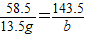 b≈33.1g>27g;故不选B;
b≈33.1g>27g;故不选B;
C、设13.5gMgCl2?10H2O完全反应生成氯化银的质量为c
MgCl2?10H2O~2AgCl
275 287
13.5g c
 c≈14.1g<27g;故可选C;
c≈14.1g<27g;故可选C;
D、设13.5gKCl完全反应生成氯化银的质量为d
KCl~AgCl
74.5 143.5
13.5g d
 d≈26g<27g;故可选D;
d≈26g<27g;故可选D;
故选CD.
点评:还可以利用元素的含量解决此问题:要使不纯的氯化铜与硝酸银生成氯化银的质量小于纯净氯化铜与之反应生成沉淀的量,氯化铜中应含有氯元素质量分数小于CuCl2的氯化物.这样可以简化计算.
CuCl2+2AgNO3═2AgCl↓+Cu(NO3)2
135 287
13.5g m
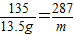 m=28.7g>27g
m=28.7g>27g说明氯化铜不纯,应含有等质量时跟足量硝酸银完全反应生成沉淀氯化银的量小于27g的氯化物;
因此,需要比较选项中四种氯化物与硝酸银反应生成沉淀的量,进行判断.
解答:解:A、设13.5gCaCl2完全反应生成氯化银的质量为a
CaCl2~2AgCl
111 287
13.5g a
 a≈34.9g>27g;故不选A;
a≈34.9g>27g;故不选A;B、设13.5gNaCl完全反应生成氯化银的质量为b
NaCl~AgCl
58.5 143.5
13.5g b
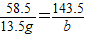 b≈33.1g>27g;故不选B;
b≈33.1g>27g;故不选B;C、设13.5gMgCl2?10H2O完全反应生成氯化银的质量为c
MgCl2?10H2O~2AgCl
275 287
13.5g c
 c≈14.1g<27g;故可选C;
c≈14.1g<27g;故可选C;D、设13.5gKCl完全反应生成氯化银的质量为d
KCl~AgCl
74.5 143.5
13.5g d
 d≈26g<27g;故可选D;
d≈26g<27g;故可选D;故选CD.
点评:还可以利用元素的含量解决此问题:要使不纯的氯化铜与硝酸银生成氯化银的质量小于纯净氯化铜与之反应生成沉淀的量,氯化铜中应含有氯元素质量分数小于CuCl2的氯化物.这样可以简化计算.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
现有含杂质的氯化铜样品13.5克,加入足量的硝酸银溶液,可得到27克白色沉淀,则样品中可能含有的杂质是( )
| A、CaCl2 | B、NaCl | C、MgCl2?10H2O | D、KCl |