题目内容
菱铁矿的主要成分是FeCO3.下列说法正确的是( )
| A、FeCO3中Fe、C、O元素的质量比是1:l:3 |
| B、FeCO3中Fe元素的质量分数约为48.3% |
| C、FeCO3中Fe、C、O的原子个数比是56:12:16 |
| D、FeCO3的相对分子质量是74 |
考点:元素质量比的计算,相对分子质量的概念及其计算,元素的质量分数计算
专题:化学式的计算
分析:A、根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
B、根据物质中某元素的质量分数=
×100%,进行解答比
C、根据化学式右下角的数字确定物质中个元素的原子个数
D、相对分子质量:是各元素的相对原子质量的总和.
B、根据物质中某元素的质量分数=
| 该元素的相对原子质量×原子个数 |
| 该物质的相对分子质量 |
C、根据化学式右下角的数字确定物质中个元素的原子个数
D、相对分子质量:是各元素的相对原子质量的总和.
解答:解:
A、FeCO3中铁、碳、氧元素的质量比为:56:12:(16×3)=14:3:12;故错;
B、FeCO3中Fe元素的质量分数为:
×100%=48.3%,故对;
C、根据化学式FeCO3Fe、C、O的元素的原子个数比为:1:1:3;故错;
D、FeCO3的相对分子质量为:56+12+16×3=116.故错.
答案:B
A、FeCO3中铁、碳、氧元素的质量比为:56:12:(16×3)=14:3:12;故错;
B、FeCO3中Fe元素的质量分数为:
| 56 |
| 56+12+16×3 |
C、根据化学式FeCO3Fe、C、O的元素的原子个数比为:1:1:3;故错;
D、FeCO3的相对分子质量为:56+12+16×3=116.故错.
答案:B
点评:本题主要考查学生根据化学式确定物质元素及根据组成物质元素之间的质量关系进行分析解题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述中属于物理变化的是( )
| A、氧气在一定的条件下能够变成液态的形式 |
| B、氧气在一定条件下转变成液态形式 |
| C、铁在潮湿的空气中能够有铁锈生成 |
| D、铁在潮湿的空气中有铁锈生成 |
下列各组微粒中,属于同一种元素的是( )
| A、Cl和Cl- |
| B、H和He |
| C、CO和CO2 |
| D、H2O和H2 |
为了用实验证明镁、铁、铜三种金属的活动性顺序,需选用的一组物质是( )?
| A、Cu、FeCl2溶液、MgCl2溶液 |
| B、Fe、Cu、MgCl2溶液? |
| C、Mg、CuO、FeSO4溶液 |
| D、Fe、CuSO4溶液、MgCl2溶液? |
下列实验操作正确的是( )
A、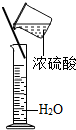 稀释浓硫酸 |
B、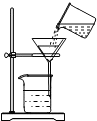 过滤 |
C、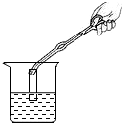 检测溶液的pH |
D、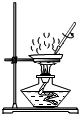 蒸发 |
我国在春秋战国时期就懂得将生铁经退火处理得到相当铸钢的器具(如锋利的宝剑),生铁退火处理的作用是( )
| A、除硫、磷杂质 |
| B、适当降低了含碳量 |
| C、渗透合金元素 |
| D、改造表面结构性质 |