题目内容
实验室有如图所示的实验装置.
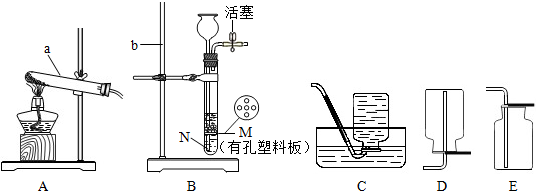
(1)写出图中有标号仪器的名称:a b .
(2)实验室有多种制取氧气的途径,如图中能用来制取氧气的组合是 (只写一组),化学方程式为 .
(3)实验室制取二氧化碳时,选用的收集装置是 ;将燃着的木条放在瓶口,若观察到 ,说明瓶中已充满二氧化碳.向该集气瓶中加A紫色石蕊溶液,振荡后,观察到溶液变红,简述此实验的目的是 .
(4)实驻室要制取0.5molCO2,需要碳酸钙多少g?要得到这些碳酸钙,需要含碳酸钙80%的大理石多少克?(假设杂质不与盐酸反应,根据化学方程式计算,并写计算过程).

(1)写出图中有标号仪器的名称:a
(2)实验室有多种制取氧气的途径,如图中能用来制取氧气的组合是
(3)实验室制取二氧化碳时,选用的收集装置是
(4)实驻室要制取0.5molCO2,需要碳酸钙多少g?要得到这些碳酸钙,需要含碳酸钙80%的大理石多少克?(假设杂质不与盐酸反应,根据化学方程式计算,并写计算过程).
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;
(3)二氧化碳能够溶于水,密度比空气大,不能燃烧,不支持燃烧;
(4)根据二氧化碳的物质的量,可以计算碳酸钙的物质的量,进一步可以计算碳酸钙、大理石的质量.
(2)氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;
(3)二氧化碳能够溶于水,密度比空气大,不能燃烧,不支持燃烧;
(4)根据二氧化碳的物质的量,可以计算碳酸钙的物质的量,进一步可以计算碳酸钙、大理石的质量.
解答:解:(1)a是试管,常用作反应容器;b是铁架台,常用来固定、支持实验装置.
故填:试管;铁架台.
(2)实验室可以用加热氯酸钾的方法制取氧气,氯酸钾在二氧化锰的催化作用下受热的化学方程式为:2KClO3
2KCl+3O2↑;
用氯酸钾和二氧化锰制取氧气需要加热,应该用A装置作为发生装置;
氧气不易溶于水,可以用排水法收集,即用C装置收集.
故填:AC;2KClO3
2KCl+3O2↑.
(3)二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用E装置收集;
把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满;
二氧化碳进入石蕊试液中时,能和其中的水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色,反应的化学方程式为:CO2+H2O═H2CO3,因此此实验的目的是:验证二氧化碳能和水反应.
故填:E;燃着的木条熄灭;验证二氧化碳能和水反应.
(4)解:设需要碳酸钙的物质的量为x,
CaCO3+2HCl═CaC12+H2O+CO2↑,
1 1
x 0.5mol
=
,
x=0.5mol,
碳酸钙的摩尔质量为100g/mol,
0.5mol碳酸钙的质量为:100g/mol×0.5mol=50g;
需要含碳酸钙80%的大理石质量为:50g÷80%=62.5g;
答:需要碳酸钙50g,需要含碳酸钙80%的大理石62.5g.
故填:试管;铁架台.
(2)实验室可以用加热氯酸钾的方法制取氧气,氯酸钾在二氧化锰的催化作用下受热的化学方程式为:2KClO3
| ||
| △ |
用氯酸钾和二氧化锰制取氧气需要加热,应该用A装置作为发生装置;
氧气不易溶于水,可以用排水法收集,即用C装置收集.
故填:AC;2KClO3
| ||
| △ |
(3)二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用E装置收集;
把燃烧的木条放在集气瓶口,如果燃烧的木条熄灭,说明已经收集满;
二氧化碳进入石蕊试液中时,能和其中的水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色,反应的化学方程式为:CO2+H2O═H2CO3,因此此实验的目的是:验证二氧化碳能和水反应.
故填:E;燃着的木条熄灭;验证二氧化碳能和水反应.
(4)解:设需要碳酸钙的物质的量为x,
CaCO3+2HCl═CaC12+H2O+CO2↑,
1 1
x 0.5mol
| 1 |
| 1 |
| x |
| 0.5mol |
x=0.5mol,
碳酸钙的摩尔质量为100g/mol,
0.5mol碳酸钙的质量为:100g/mol×0.5mol=50g;
需要含碳酸钙80%的大理石质量为:50g÷80%=62.5g;
答:需要碳酸钙50g,需要含碳酸钙80%的大理石62.5g.
点评:本题主要考查仪器的用途、化学方程式的书写、实验装置的选择和根据化学方程式进行计算,进行计算时要注意规范性和准确性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目