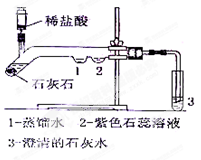
题目内容
除去下列物质中的少量杂质所选用的试剂或方法正确的是
| 选项 | 物质 | 所含杂质 | 所选用试剂或方法 |
| A | NaOH溶液 | Na2CO3溶液 | 稀盐酸 |
| B | CaO | CaCO3 | 高温灼烧 |
| C | CO2 | CO | 点燃 |
| D | 稀盐酸 | 稀硫酸 | 加适量Ba(NO3)2溶液,再过滤 |
B
解析试题分析:一般的除杂质题必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质。A.NaOH溶液和Na2CO3溶液都能与稀盐酸反应,因此不可行,故选项错误;B.碳酸钙在高温的条件下生成氧化钙和二氧化碳,可以除去碳酸钙,故选项正确;C.二氧化碳多,杂质一氧化碳少,无法点燃,故选项错误;D.杂质硫酸与硝酸钡反应生成硫酸钡白色沉淀和硝酸,硝酸是新的杂质,故选项错误;故选B
考点:物质除杂或净化的探究;常见气体的检验与除杂方法;酸的化学性质;盐的化学性质

练习册系列答案
相关题目
在以下的“四连环”图中,每环代表一种物质,相连环间所代表的物质在一定条件下可以发生反应,下表的选项中,符合这一要求的是( )
| | A | B | C | D |
| 甲 | Cu | HCl | O2 | Na2CO3 |
| 乙 | HCl | NaOH | CO | HCl |
| 丙 | Fe2O3 | CaCO3 | Fe2O3 | NaOH |
| 丁 | Mg | NaCl | HCl | H2SO4 |

甲、X、Y、Z是初中化学中的常见物质,请根据下列叙述回答问题。
(1)若甲是生命活动中最重要的气体单质,则甲是 。
(2)若甲既可以作气体燃料,又可以用作还原剂冶炼金属铁。则甲的化学式是 ;用其还原氧化铁的化学反应方程式是 。
(3)若甲可以由Y与水在常温下反应制得,且可用来改良酸性土壤,则下列叙述正确的是 (填字母序号)。
| A.Y与水的反应属于化合反应 |
| B.甲易吸收空气中的水分而变质,所以需密封保存 |
| C.向滴有酚酞试液的甲的溶液中加入一定量的稀盐酸,溶液最终为无色,则所得溶液中的溶质只有CaCl2 |
| D.将少量Y加到甲的饱和溶液中,溶液变浑浊,反应后溶液中溶质和溶剂的质量一定减小,溶质的质量分数可能不变 |
(7分)已知某合金样品中可能含有铝、铁、铜中的两种或三种。某小组同学对该合金样品的成分进行探究。
【查阅资料】铝与氢氧化钠溶液可以发生反应,而铁、铜不与氢氧化钠溶液反应。
已知2Al + 2NaOH + 2X= 2NaAlO2 + H2↑,则X的化学式是 。
【探究实验】
| 实验方案 | 实验现象 | 结论 |
| 取一定量的合金样品,加过量的 ,充分反应后过滤,滤渣备用。 取步骤①所得滤渣,加 。 | 样品部分溶解,并有气体放出。 | 合金中一定含有 。 合金中一定含有铁和铜。 |
将Al、Cu分别加入到FeSO4溶液中
将Al、Fe分别加入到CuSO4溶液中
将Al分别加入到FeSO4、CuSO4溶液中
将Fe分别加入到Al2(SO4)3、CuSO4溶液中
下列实验方案中,不能达到实验目的是
| A.用蒸馏的方法从食盐水中获得淡水 |
| B.用氧化铜和稀硫酸反应制取硫酸铜溶液 |
| C.用酚酞试液检验暴露在空气中的NaOH固体是否变质 |
| D.在没有指示剂的情况下,用过量碳酸钙粉末调节含有盐酸的氯化钙溶液为中性 |
下列实验现象与实验结论都正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将一根未打磨的铝条放入硫酸铜溶液中 | 无紫红色固体析出 | 铝不如铜活泼 |
| B | 将带火星的木条伸入氧气中 | 木条复燃 | 氧气能支持燃烧 |
| C | 将CO通入灼热的氧化铜 | 黑色氧化铜变成红色 | CO具有可燃性 |
| D | 将二氧化碳通入紫色石蕊试液中 | 紫色石蕊试液变成红色 | CO2具有酸性 |
下列各组对比实验,能达到实验目的是
| | 实验目的 | 实验方案 |
| A | 探究燃烧所有条件 |  . . |
| B | 探究铁生锈所有条件 |  |
| C | 探究MnO2对过氧化氢溶液 分解速度的影响 |  |
| D | 实验室制取二氧化碳的药品研究 |  |
下列对比实验,得到的实验结论错误的是
| | 实验方案 | 实验结论 | |
| 实验1 | 实验2 | ||
| A |  |  | 白磷燃烧需要氧气 |
| B |  | 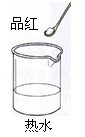 | 温度升高,分子运动速率加快 |
| C |  |  | 金属M生锈需要氧气和水 |
| D |  | 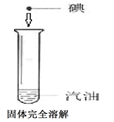 | 碘在水和汽油中的溶解性相同 |