题目内容
【题目】某工厂欲测定铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
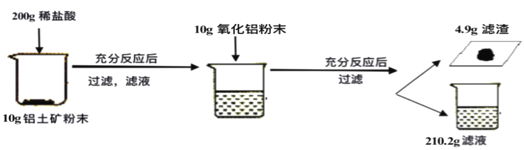
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为 ___________;
(2)铝土矿中Al2O3的质量分数为_______;
(3)列出求解与铝土矿反应消耗的稀盐酸中溶质质量(X)的比例式__________;
(4)若要使最终所得滤液溶质质量分数变为10%,接下来的操作__________;
(5)该炼铝厂每天用上述铝土矿50t来生产铝合金,则理论上日产含镁40%的铝镁合金的质量为_________。
【答案】![]() 51%
51% ![]() 向最终所得滤液中加入56.8g水并混合均匀 22.5t
向最终所得滤液中加入56.8g水并混合均匀 22.5t
【解析】
(1)上述实验过程中发生反应的化学方程式为:![]() 。
。
(2)铝土矿中![]() 的质量为10g-4.9g=5.1g。
的质量为10g-4.9g=5.1g。
铝土矿中![]() 的质量分数为:
的质量分数为:![]() 。
。
(3)设与铝土矿反应消耗的稀盐酸中溶质质量X,反应生成氯化铝质量为y,则
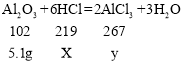
![]()
![]()
y=13.35g;
(4)由数据可知,第二次加入10g氧化铝粉末消耗的氧化铝的质量同样为5.1g,所以最终所得滤液溶质质量为13.35g×2=26.7g,使最终所得滤液溶质质量分数变为10%,溶液的质量为![]() ,所以需要加入水的质量为267g-210.2g=56.8g;
,所以需要加入水的质量为267g-210.2g=56.8g;
故填:向最终所得滤液中加入56.8g水并混合均匀;
(5)理论上日产含镁40%的铝镁合金的质量为:![]() .
.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目