题目内容
【题目】探索化学世界的奥秘,需要掌握科学的方法。
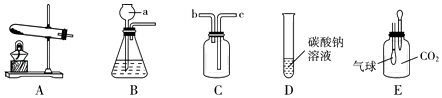
(1)实验是学习化学的一条重要途径。观察下图实验装置,回答下列问题。
若用高锰酸钾来制取氧气,应选择装置(填字母),化学反应方程式为;为了在较短时间内获得尽可能纯净的氧气,所选的收集装置为(填字母)。
(2)“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方式。图A、B是从不同视角对稀盐酸与氢氧化钠的反应描述,其中图A表示实际操作,图B表示反应过程中微观粒子的变化情况。
①图A中仪器a的名称是。
②由图B可以看出,该反应中实际参与反应的离子是(填离子符号)。
③另取29.4g稀硫酸于烧杯中,匀速滴加质量分数为15%的NaOH溶液,并用传感器实时测定混合溶液的pH和温度变化情况,所得曲线如图C。
根据图C分析,硫酸和氢氧化钠的反应属于(填“吸热”或“放热”)反应;若当加入的NaOH溶液的质量为40g时,混合溶液的pH=7,试求所用的稀硫酸中溶质的质量分数(写出解题过程,否则不得分)。
【答案】
(1)A,2KMnO4 ![]() K2MnO4 + MnO2 + O2↑,C
K2MnO4 + MnO2 + O2↑,C
(2)烧杯,H+、OH-(漏、误均不得分),放热,解:设所用的稀硫酸中溶质的质量为xH2SO4+2NaOH=2H2O+Na2SO4 98 8029.4g×x 40g×15%=, x=7.35g 所用的稀硫酸中溶质的质量分数 7.35g÷29.4g×100%=25%
【解析】(1)高锰酸钾法制氧气应选择固固加热型发生装置A. 高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰、氧气.2KMnO4 K2MnO4 + MnO2 + O2↑;氧气的密度比空气的大,可以用向上排空气法收集,氧气难溶于水可以用排水法收集,排水法收集气体较纯净;
(2)①图A中仪器a是烧杯;
②从图中微粒的变化可以看出,该反应的实质是:氢离子和氢氧根离子结合生成水分子;
③由图可知,硫酸和氢氧化钠的反应属于放热反应;
设所用的稀硫酸中溶质的质量为x,
H2SO4+2NaOH=2H2O+Na2SO4
98 80
29.4g×x 40g×15%![]() =
=![]()
解得x=25%。
故答案为:(1)A;2KMnO4 K2MnO4 + MnO2 + O2↑;C;(2)烧杯 ;H+、OH-;;放热 ;25%.
(1)根据实验室用高锰酸钾制取氧气的反应物的状态和反应条件可选择发生装置;根据氧气的密度以及溶于水的程度可以选择收集装置,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,根据化学反应方程式的书写步骤可写成高锰酸钾制取氧气的化学反应方程式.
(2)①根据常见仪器的名称即可解答;②酸和碱反应的实质是H+和OH-结合生成水;③根据曲线图分析可得知硫酸和氢氧化钠的反应属于吸热还是放热反应;写出氢氧化钠与硫酸反应的化学方程式,然后结合氢氧化钠溶液中溶质的质量即可计算所用的稀硫酸中溶质的质量分数.