题目内容
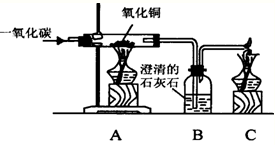 某同学使用如图所示装置,试验一氧化碳与氧化铜的反应.请回答下列有关问题:
某同学使用如图所示装置,试验一氧化碳与氧化铜的反应.请回答下列有关问题:(1)实验操作中A和C处都要点燃酒精灯,先应该被点燃的是
C
C
(填序号)(2)实验进行一段时间后,A装置中出现的现象为
固体颜色由黑变红
固体颜色由黑变红
,B装置中出现的现象为澄清石灰水变浑浊
澄清石灰水变浑浊
.(3)写出在硬质玻璃管中发生的化学反应的方程式
CO+CuO
Cu+CO2
| ||
CO+CuO
Cu+CO2
| ||
(4)若利用这套装置来测定氧化铜样品中氧化铜的纯度,测定方法如下:开始前称量硬质玻璃管质量为50g,加入样品后称量得硬质管与样品的总质量为60g,完全反应后称量图中B装置,发现装置总质量增加了4.4g,则通过计算求得样品中氧化铜的质量分数为
80%
80%
.分析:(1)根据点燃前要先通入一氧化碳气体使装置中的空气排净,然后再加热,防止气体不纯,加热时发生爆炸,分析解题;
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
Cu+CO2,据此可推测出实验现象;
(3)一氧化碳在高温下还原氧化铜,生成铜和二氧化碳;
(4)根据提供的数据和一氧化碳还原氧化铜的化学反应式分析计算.
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
| ||
(3)一氧化碳在高温下还原氧化铜,生成铜和二氧化碳;
(4)根据提供的数据和一氧化碳还原氧化铜的化学反应式分析计算.
解答:解:(1)由于一氧化碳气体是可燃性气体,所以在点燃前要先通入一氧化碳气体使装置中的空气排净,然后再加热,防止气体不纯,加热时发生爆炸.所以为防止一氧化碳污染空气,所以要先点燃C出的酒精灯.
故答案为:C
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
Cu+CO2,所以实验进行一段时间后,A装置中出现的现象为:有红色物质出现,说明有单质铜生成;B装置中出现的现象为澄清石灰水变浑浊,说明有二氧化碳生成.
故答案为:固体颜色由黑变红;澄清石灰水变浑浊.
(3)一氧化碳在高温下还原氧化铜,生成铜和二氧化碳.
故答案为:CO+CuO
Cu+CO2.
(4)开始前称量硬质玻璃管质量为50g,加入样品后称量得硬质管与样品的总质量为60g,说明加入了60-50=10g氧化铜,并且完全反应,所以根据一氧化碳还原氧化铜的反应式就可计算出样品中氧化铜的质量分数.
设完全反应后生成铜的质量为X
CO+CuO
Cu+CO2
80 64
10g X
=
X=8g
所以样品中氧化铜的质量分数是:
×100%=80%.
故答案为:80%.
故答案为:C
(2)一氧化碳还原氧化铜的反应原理为:CO+CuO
| ||
故答案为:固体颜色由黑变红;澄清石灰水变浑浊.
(3)一氧化碳在高温下还原氧化铜,生成铜和二氧化碳.
故答案为:CO+CuO
| ||
(4)开始前称量硬质玻璃管质量为50g,加入样品后称量得硬质管与样品的总质量为60g,说明加入了60-50=10g氧化铜,并且完全反应,所以根据一氧化碳还原氧化铜的反应式就可计算出样品中氧化铜的质量分数.
设完全反应后生成铜的质量为X
CO+CuO
| ||
80 64
10g X
| 80 |
| 10g |
| 64 |
| X |
X=8g
所以样品中氧化铜的质量分数是:
| 8g |
| 10g |
故答案为:80%.
点评:主要考查了一氧化碳的化学性质.要掌握一氧化碳还原氧化铜的实验中的现象和注意事项,并会根据反应现象寻出本质,常用的化学反应要记住:CO+CuO
Cu+CO2.
| ||

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下,铁与水几乎不反应,但高温下,铁能与水蒸气反应,生成四氧化三铁(磁铁矿的主要成分)和氢气.请设计实验,证明铁粉与水蒸气能够发生反应并且产生了氢气.
(1)铁粉与水蒸气反应的化学方程式是: ,该反应的基本反应类型是 .
(2)某兴趣小组同学用如图所示装置进行实验(D可以重复利用),请你协助该小组同学完成以下实验:①实验结束后,发现B中铁粉全部转化产生了黑色块状固体,为了证明黑色固体不是铁粉,该兴趣小组同学取黑色固体进行实验,请你帮他们完成下列实验报告:
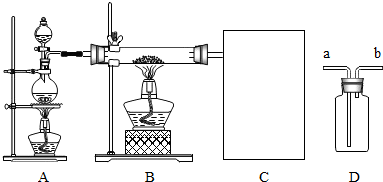
②为了除去B中出来的水蒸气,该小组同学在C中首先连接了D作为洗气装置对氢气进行干燥,则D瓶中填装的药品可以是 ;
③为了收集和验证所产生的氢气,该小组同学使用D作为气体的收集装置,则气体应该从 (填“a”或“b”)通入.
④实验室通常用浓盐酸与二氧化锰共热的方法来制取氯气,一般可选用装置A做气体的发生装置,理由是 .
(1)铁粉与水蒸气反应的化学方程式是:
(2)某兴趣小组同学用如图所示装置进行实验(D可以重复利用),请你协助该小组同学完成以下实验:①实验结束后,发现B中铁粉全部转化产生了黑色块状固体,为了证明黑色固体不是铁粉,该兴趣小组同学取黑色固体进行实验,请你帮他们完成下列实验报告:

| 实验操作 | 实验现象 | 实验结论 |
| 黑色固体不是铁粉 |
③为了收集和验证所产生的氢气,该小组同学使用D作为气体的收集装置,则气体应该从
④实验室通常用浓盐酸与二氧化锰共热的方法来制取氯气,一般可选用装置A做气体的发生装置,理由是
常温下,铁与水几乎不反应,但高温下,铁能与水蒸气反应,生成四氧化三铁(磁铁矿的主要成分)和氢气.请设计实验,证明铁粉与水蒸气能够发生反应并且产生了氢气.
(1)铁粉与水蒸气反应的化学方程式是:______,该反应的基本反应类型是______.

(2)某兴趣小组同学用如图所示装置进行实验(D可以重复利用),请你协助该小组同学完成以下实验:①实验结束后,发现B中铁粉全部转化产生了黑色块状固体,为了证明黑色固体不是铁粉,该兴趣小组同学取黑色固体进行实验,请你帮他们完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 黑色固体不是铁粉 |
③为了收集和验证所产生的氢气,该小组同学使用D作为气体的收集装置,则气体应该从______(填“a”或“b”)通入.
④实验室通常用浓盐酸与二氧化锰共热的方法来制取氯气,一般可选用装置A做气体的发生装置,理由是______.
常温下,铁与水几乎不反应,但高温下,铁能与水蒸气反应,生成四氧化三铁和氢气.请设计实验,证明铁粉与水蒸气能够发生反应并且产生了氢气.
(1)铁粉与水蒸气反应的化学方程式是:______.

(2)某兴趣小组同学用如图所示装置进行实验(D可以重复利用),请你协助该小组同学完成以下实验:①实验结束后,发现B中铁粉全部转化产生了黑色块状固体,为了证明黑色固体不是铁粉,该兴趣小组同学取黑色固体进行实验,请你帮他们完成下列实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 黑色固体不是铁粉 |
③为了收集和验证所产生的氢气,该小组同学使用D作为气体的收集装置,则气体应该从______(填“a”或“b”)通入.