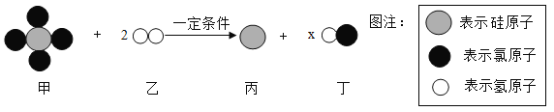
题目内容
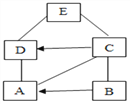
【题目】小吴用铁、硫酸、氢氧化钡、硫酸铜和碳酸钠五中物质玩化学拼图游戏(如图),游戏规则要求图中相邻物质之间能发生反应.其中C物质的溶液呈蓝色,A与E反应产生的气体是光合作用的原料之一.
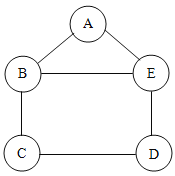
(1)C物质是_________________(写化学式),E物质的一种用途是_________________________________。
(2)B与E的反应的实验方程式为___________________________________________________,基本反应类型为__________________________________;C与过量的D反应的实验现象是__________________________________。
(3)按照游戏规则,下列能题替代B 物质的是______________________(填序号)
①银 ②氯化铁 ③氯化钡 ④氧化铜
【答案】CuSO4 除锈 Ba(OH)2+H2SO4=BaSO4↓+2H2O 复分解反应 溶液由无色变成浅绿色,有气泡冒出,铁在逐渐减少或消失 ③
【解析】
根据C物质的溶液呈蓝色,则C是硫酸铜;A与E反应产生的气体是光合作用的原料之一,则产生的气体是二氧化碳,能反应生成二氧化碳的物质是硫酸和碳酸钠,故A和E是硫酸和碳酸钠中的一种;B既能和碳酸钠也能与硫酸反应,故B是氢氧化钡;D是铁,铁能与硫酸反应,故E是硫酸,A是碳酸钠,代入框图,推断合理;
(1)根据分析,C是硫酸铜,E是硫酸,可用于除锈等,故填:CuSO4,除锈;
(2)B是氢氧化钡,E是硫酸,氢氧化钡能与硫酸反应生成硫酸钡和水,该反应属于复分解反应,故填:Ba(OH)2+H2SO4=BaSO4↓+2H2O,复分解反应;C与过量的D反应,即铁与硫酸铜溶液反应,实验现象是:溶液由无色变成浅绿色,有气泡冒出,铁在逐渐减少或消失;
(3)①银不与硫酸反应,错误;
②氯化铁不与硫酸反应,错误;
③氯化钡能与碳酸钠反应生成碳酸钡沉淀和氯化钠,能与硫酸反应生成硫酸钡沉淀和盐酸,能与硫酸铜反应生成硫酸钡沉淀和氯化铜,可以代替氢氧化钡,正确;
④氧化铜不与碳酸钠反应,错误;
故填:③。

【题目】某化学兴趣小组同学用大理石和盐酸反应制取CO2,将制得的气体通入新制的饱和澄清石灰水时,发现有气泡冒出,但一段时间后仍不变浑浊。对此展开了探究活动。
(提出问题)澄清石灰水未变浑浊的原因是什么?
(猜想与假设)
I.制得气体中无CO2,II、与盐酸的浓度有关
(进行实验)
I.初步实验—实验1小组同学取等量原试剂瓶中澄清石灰水于试管内进行实验
实验操作 | 现象 | 初步结论 |
| 试管1澄清石灰水未变浑浊 试管2澄清石灰水变浑浊 | (1)可知猜想I____(填“成立”或“不成立”)。 (2)写出试管②中发生的化学反应方程式_____。 |
II.依据初步结论,深入探究;实验2
实验序号 | ① | ② | ③ | ④ | ⑤ |
大理石质量(g) | 10 | 10 | 10 | 10 | 10 |
盐酸质量分数(%) | 37.5 | 20.3 | 13.9 | 10.6 | 8.5 |
盐酸体积(mL) | 10 | 10 | 10 | 10 | 10 |
将产生的气体通入5mL新制饱和澄清石灰水中的现象 | 无 | 无 | 出现浑浊 | 出现浑浊 | 出现浑浊 |
实验3: 125 mL集气瓶中充入不同体积CO2进行实验
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
CO2体积(mL) | 3 | 25 | 50 | 75 | 100 | 125 |
加入5ml饱和澄清石灰水振荡5次现象 | 澄清 | 变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 | 变浑浊 |
振荡30次后现象 | 澄清 | 浑浊 | 浑浊 | 浑浊 | 澄清 | 澄清 |
(解释与结论)
(3)实验2的目的是_______
(4)有一定量HCl气体存在时,请解释澄清石灰水不变浑浊原因是_______
(5)由实验2,可推测质量分数为9.5%的盐酸参加反应,其可能的现象是_______
(反思与评价)
(6)由实验3可知,用澄清的石灰水检验二氧化碳时,为了得到准确的实验现象,加入二氧化碳的量不能过少也不能过多。得出此结论所依据的现象是_______