题目内容
50g质量分数为36.5%的盐酸与30g大理石恰好完全反应(大理石中的杂质不参加反应)。(1)计算反应生成二氧化碳气体的质量。
(2)计算该大理石中碳酸钙的质量分数。
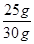
解:设反应生成二氧化碳气体的质量为x,30g大理石中碳酸钙的质量为y。
CaCO3 + 2HCl = CaCl2+H2O+ CO2↑ ················ ·1分
100 2×36.5 44
y 50g×36.5% x
73︰44 = 18.25g︰x x=11g ···········1分
73︰100 = 18.25g︰y y=25g ············1分
大理石中碳酸钙的质量分数为: ×100%≈83.3% ···········1分
答:(略)解析:
本题考查的就是根据化学方程式的计算,已知量为盐酸的溶质质量,50g×36.5%=18.25g,据此就可以求二氧化碳和碳酸钙的质量了,具体步骤见答案。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目