题目内容
【题目】某碳酸钙和氧化钙组成的混合物中钙元素的质量分数为60%,将100 g该混合物高温煅烧至固体质量不再改变,有关结论正确的是
A. 煅烧后固体中钙元素的质量分数减少
B. 共生成56 g氧化钙
C. 煅烧前后固体中氧元素的质量不变
D. 共生成16 g二氧化碳
【答案】D
【解析】
A、该混合物高温煅烧后,有二氧化碳生成,固体的总质量减少,钙元素的质量不变,故钙元素的质量分数增加,故错误;
B、100g该混合物中钙元素的质量为100g×60%=60g,含60g钙元素的氧化钙的质量为60g÷(![]() )=84g,则生成二氧化碳的质量为100g-84g=16g,设生成氧化钙的质量为x
)=84g,则生成二氧化碳的质量为100g-84g=16g,设生成氧化钙的质量为x
CaCO3高温CaO+CO2↑
56 44
X 16g
![]() =
=![]() ,解得x=20.4g,故错误;
,解得x=20.4g,故错误;
C、煅烧后有二氧化碳气体生成,故煅烧后固体中部分氧元素转化为二氧化碳中的氧元素,故固体中氧元素的质量减少,故错误;
D、由上分析,共生成二氧化碳的质量为16g,故正确。故选D。

 名校课堂系列答案
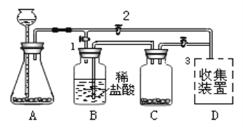
名校课堂系列答案【题目】某白色固体可能由BaC12、NaOH、Na2CO3、Na2SO4中的一种或几种物质组成,某兴趣小组的同学为确定该白色固体的成分,进行了如下的实验探究,请你参与并回答相关问题。
I.初步探究:小金同学设计的实验过程及现象如下图所示。
(查阅资料)BaC12溶液显中性。

(初步结沦)(1)原白色固体中一定有的物质是_________,一定没有的物质是_________。
(2)M溶液中的溶质一定有__________,一定没有氯化钡。
(交流讨论)小英同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠。若要进一步确定,需对溶液M继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究:
(提出问题)无色溶液M中有氢氧化钠吗?
(猜想与假设)猜想一:有NaOH
猜想二:没有NaOH
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
A.取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置 | _______________ | 证明溶液M中有碳酸钠并被除尽 |
B.取实验A所得上层清液于试管中,加入_______________。 | _____________ | 猜想一正确 |
在老师的指导下,同学们通过交流、讨论、实验,圆满地完成了这次探究活动。
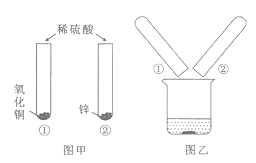
【题目】请从A、B两题中任选一个作答。若两题均答,按A计分。
题号 | A | B |
实验目的 | 探究_________ | 探究________ |
实验装置 |
|
|
实验原理 | (1)化学方程式是_______ | (1)化学方程式是_______ |
部分实验现象 | (2)溶液蓝色逐渐变浅,天平指针_______; | (2)如图,缓慢打开左端活塞,a处可观察到_______; |