题目内容
用文字表达式或符号表达式完成下列反应,并在括号中注明反应的基本类型。
⑴硫在空气中燃烧 ( )
⑵过氧化氢溶液和二氧化锰混合制氧气_________________________( )
⑶红磷的燃烧
⑷氯酸钾和二氧化锰混合加热
⑸木炭在空气中燃烧_______________________________________
⑹氢气和氧化铜在加热的条件下生成铜和水_____________________________
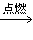 SO2 化学反应
SO2 化学反应(2)2H2O2
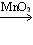 2H2O+ O2↑ 分解反应
2H2O+ O2↑ 分解反应(3)4P + 5O2
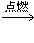 2P2O5
2P2O5 (4)2KClO3
 2KCl + 3O2 ↑
2KCl + 3O2 ↑ (5)C + O2
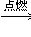 CO2
CO2 (6)H2 + CuO
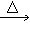 Cu + H2O
Cu + H2O 
 名校课堂系列答案
名校课堂系列答案被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的双氧水(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体。在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
| 实验步骤 | 实验现象 | 实验结论 |
|
②分别向A、B两试管中 同时加入等质量(少量) 的二氧化锰,观察现象。 | A试管中无明显现象 B试管中有气泡产生 | A试管中的无色液体是:________; B试管中的无色液体是:________ |
(1)B试管中发生反应的文字或符号表达式:_____________ ___
(2)如何验证B试管中产生的气体,请试着完成下表:
| 猜想 | 验证方法及操作 | 实验现象 | 结论 |
酒精是一种无色、透明、有特殊气味的液体,易挥发,能与水以任意比互溶,常用作酒精灯和内燃机的燃料,是一种绿色能源,当点燃酒精灯时,酒精在灯芯上气化后燃烧生成水和二氧化碳。
(1)根据以上叙述,可归纳出酒精的物理性质是 ;化学性质是 ;酒精的用途是 。
(2)向燃着的酒精灯添加酒精可能造成的不良后果: 。
(3)下列仪器不能用酒精灯加热的是_____________
A.燃烧匙 B.试管 C.量筒 D.蒸发皿
(4)某研究小组在学习氧气的化学性质时发现:铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
① 写出铁丝在氧气中燃烧的文字(或符号)表达式 。
 ② 探究一:蜡烛燃烧产生火焰的原因是什么?
② 探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,
在另一端管口点燃,也有火焰产生(如右图所示)。由此可知:
蜡烛燃烧产生的火焰是由 (填“固态”或“气态”)
物质燃烧形成的。
③ 探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 | 熔点╱℃ | 沸点╱℃ | 燃烧时温度╱℃ |
| 石蜡 | 50~70 | 300~550 | 约600 |
| 铁 | 1535 | 2750 | 约1800 |
| 钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其 (填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰
。由此推测:钠在燃烧时, (填“有”或“没有”)火焰产生。
④ 根据硫在空气或氧气中燃烧的实验事实,请你推测硫沸点 硫燃烧时的温度(填“>”或“<”或“=”)。
实验室常利用以下装置完成气体制备及性质实验。请回答:
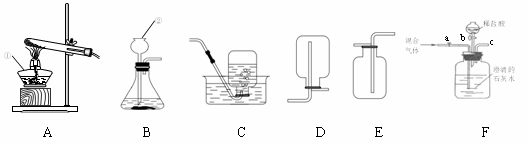
(1)指出编号仪器的名称:① ▲ ,② ▲ 。
(2)A—E装置中有一明显错误的是 ▲ ,错误为 ▲ 。利用改正后的装置继续完成后面的实验。
(3)欲使用高锰酸钾制取氧气,应选择的发生装置是 ▲ (填字母),反应原理用符号表达式(或文字表达式)表示 为 ▲ ;为防止高锰酸钾粉末进入导管,应采取的措施是 ▲ ;若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒
为 ▲ ;为防止高锰酸钾粉末进入导管,应采取的措施是 ▲ ;若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒 精灯,原因是 ▲ 。
精灯,原因是 ▲ 。
(4)氧气收集完成后,测得其纯度明显偏低,原因可能是: ▲ (填字母);
A.高锰酸钾中混入了二氧化锰 B.收集前,集气瓶中未注满水
C.收集后,集气瓶中仍有少量水  D.未见气泡连续均匀冒出时就开始收集
D.未见气泡连续均匀冒出时就开始收集
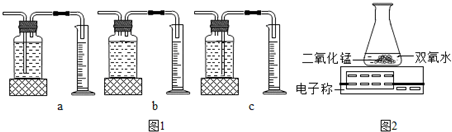
(5)在研究“适于制取氧气的物质及其反应条件”的过程中,某同学完成了下表所示系列实验:
| 序号 | 实验 | 能否生成氧气 |
| A | 加热高锰酸钾 | 能 |
| B | 加热二氧化硅 | 不能 |
| C | 加热氯化钠 | 不能 |
| D | 加热水 | 不能 |
| E | 电解水 | 能 |
①根据实验A、B、C,可以得出的结论是:在一定条件下, ▲ ;
②根据实验D、E,可以得出的结论是: ▲ 是影响物质能否反应产生氧气的重要因素;
(6)将CO2和CO的混合气体通过F装置(液体药品均足量,CO不和液体反应),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是 ▲ ,此时从导管c逸出的气体主要是  ▲ 。一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是 ▲ ,反应原理用符号表达式(或文字表达式)表示为 ▲ ,欲收集该气体,应选择的装置是 ▲ (填字母),验满的方法是 ▲ 。
▲ 。一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是 ▲ ,反应原理用符号表达式(或文字表达式)表示为 ▲ ,欲收集该气体,应选择的装置是 ▲ (填字母),验满的方法是 ▲ 。

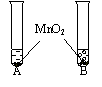 ①将等体积
①将等体积 的两种无色液体分别加入A、B两个试管中。
的两种无色液体分别加入A、B两个试管中。