题目内容
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验。
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
(1)根据质量守恒定律得:m(CO2)=(100.0g+12.0g)-107.6g=4.4g
(2)设12.0g石灰石样品中含CaCO3质量为x
CaCO3+2HCl==CaCl2+CO2↑+H2O
100 44
x 4.4g
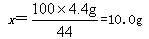
该石灰石样品的纯度为: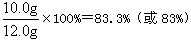
因83.3%<85%,所以该石灰石样品的纯度不符合要求。
(2)设12.0g石灰石样品中含CaCO3质量为x
CaCO3+2HCl==CaCl2+CO2↑+H2O
100 44
x 4.4g
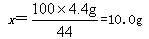
该石灰石样品的纯度为:
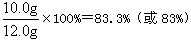
因83.3%<85%,所以该石灰石样品的纯度不符合要求。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
石灰石是我市主要矿产之一,小江同学为了寻找纯度[石灰石中碳酸钙的质量分数]超过80%的石灰石,对一样品进行了如下定量实验.
试通过分析计算:
(1)求出该实验中生成的二氧化碳的质量为 g.
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)[该反应的化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O].
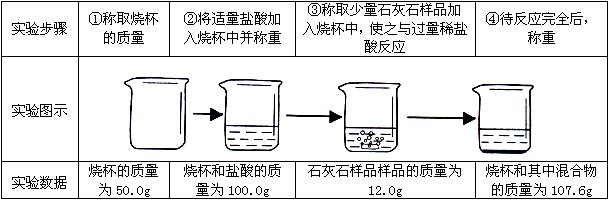
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 | 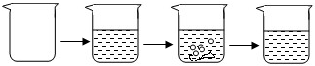 | |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
(1)求出该实验中生成的二氧化碳的质量为
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)[该反应的化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O].
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验.
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 |  | |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
石灰石是我市主要矿产之一,小江同学为了寻找纯度[石灰石中碳酸钙的质量分数]超过80%的石灰石,对一样品进行了如下定量实验.
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 | 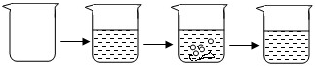 | |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
(1)求出该实验中生成的二氧化碳的质量为______g.
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)[该反应的化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O].
石灰石是我市主要矿产之一,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验.
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 | 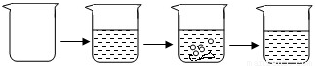 | |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)