题目内容
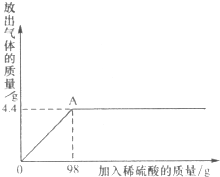
 取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示,请根据题意解答问题:
取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示,请根据题意解答问题:(1)当加入196g稀硫酸时,放出气体的质量为
(2)计算加入的稀硫酸溶液溶质的质量分数为
(3)试通过计算求出加入98g稀硫酸(即A点)时烧杯中溶液溶质的质量分数.(写出计算过程)
分析:(1)由图可知:当加入98g稀硫酸时,碳酸钠恰好完全反应;则再加稀硫酸时,产生气体的质量是不变的;根据图示数据,找出与纵坐标98对应的横坐标的数值即为放出气体的质量;
(2)利用碳酸钠与硫酸反应的化学方程式和生成二氧化碳的质量,列出比例式,就可计算出完全反应时参与反应的H2SO4质量;然后根据溶质质量分数公式即可求出所加入的稀硫酸的溶质质量分数;
(3)完全反应后(即A点),溶液中的溶质为Na2SO4.利用碳酸钠与硫酸反应的化学方程式可计算出反应生成Na2SO4的质量和Na2CO3样品质量;进而计算出溶液质量=Na2CO3样品质量+水的质量+稀硫酸质量-生成二氧化碳的质量;然后根据溶质质量分数公式计算即可.
(2)利用碳酸钠与硫酸反应的化学方程式和生成二氧化碳的质量,列出比例式,就可计算出完全反应时参与反应的H2SO4质量;然后根据溶质质量分数公式即可求出所加入的稀硫酸的溶质质量分数;
(3)完全反应后(即A点),溶液中的溶质为Na2SO4.利用碳酸钠与硫酸反应的化学方程式可计算出反应生成Na2SO4的质量和Na2CO3样品质量;进而计算出溶液质量=Na2CO3样品质量+水的质量+稀硫酸质量-生成二氧化碳的质量;然后根据溶质质量分数公式计算即可.
解答:解:(1)根据图示数据可知,纵坐标加入稀硫酸98g时,反应已完全,对应的横坐标放出气体的质量为4.4g;
再加入稀硫酸时,产生气体的质量是不变的;
故当加入196g稀硫酸时,放出气体的质量为4.4g;
故答案为:4.4.
(2)设完全反应时参与反应的H2SO4质量为z,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
98 44
z 4.4g
=
解得:z=9.8g;
则所加入的稀硫酸的溶质质量分数为:
×100%=10%;
故答案为:10%.
(3)设参加反应的碳酸钠的质量为x,反应生成Na2SO4的质量为y;
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 142 44
x y 4.4g
=
,
=
;
解得:x=10.6g,y=14.2g;
则加入98g稀硫酸(即A点)时烧杯中溶液质量为:10.6g+95.8g+98g-4.4g=200g;
则加入98g稀硫酸(即A点)时烧杯中溶液溶质的质量分数为:
×100%=7.1%.
答:加入98g稀硫酸(即A点)时烧杯中溶液溶质的质量分数为7.1%.
再加入稀硫酸时,产生气体的质量是不变的;
故当加入196g稀硫酸时,放出气体的质量为4.4g;
故答案为:4.4.
(2)设完全反应时参与反应的H2SO4质量为z,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
98 44
z 4.4g
|
|
解得:z=9.8g;
则所加入的稀硫酸的溶质质量分数为:
|
故答案为:10%.
(3)设参加反应的碳酸钠的质量为x,反应生成Na2SO4的质量为y;
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 142 44
x y 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
| 142 |
| y |
| 44 |
| 4.4g |
解得:x=10.6g,y=14.2g;
则加入98g稀硫酸(即A点)时烧杯中溶液质量为:10.6g+95.8g+98g-4.4g=200g;
则加入98g稀硫酸(即A点)时烧杯中溶液溶质的质量分数为:
| 14.2g |
| 200g |
答:加入98g稀硫酸(即A点)时烧杯中溶液溶质的质量分数为7.1%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式解答问题的能力.要求学生了解完全反应的概念,能正确分析坐标图,从图中找出有效数据进行计算.解题时要注意格式和步骤,计算要细心.

练习册系列答案
相关题目
 取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示.请根据题意求出加入的稀硫酸溶液的质量分数.
取某碳酸钠样品放入烧杯中,加入95.8g水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如图所示.请根据题意求出加入的稀硫酸溶液的质量分数.