题目内容
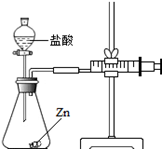
根据下列装置图1,回答有关问题: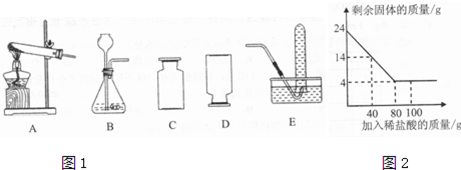
(1)用高锰酸钾制取氧气的化学方程式为 _______ .若选择A作该反应的发生装置,则装置A中的试管口还要放一团 _________ ,且试管口略微向下倾斜,原因是 _________ .
(2)实验室制取某气体时,即可用D也可用E装置收集,由此推测该气体所具有的物理性质是 ___ (填序号).
a.该气体的密度大于空气 b.该气体难溶于水 c.该气体的密度小于空气
(3)实验室制取CO2有以下主要步骤:①连接好装置;② _________ ;③向试管中小心放入几小块石灰石;④向试管中小心注入适量稀盐酸;⑤收集产生的气体;⑥用燃烧的木条检验收集瓶是否收集满CO2.
(4)若要用装置E收集CO2气体,要将水换成温水,其理由是 _________ .
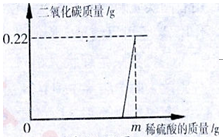
(5)某化学兴趣小组为了测定当地的石灰石中CaCO3的质量分数,他们做了如下实验:取24g样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用盐酸的质量分数与剩余固体的质量关系如图2所示,请根据图中的数据进行计算:
(a)石灰石样品中CaCO3的质量为 _________ 克.
(b)24克石灰石样品与盐酸充分反应后最多产生多少克二氧化碳?(请根据化学方程式写出完整的计算步骤)
(1)2KMnO4 △K2MnO4+MnO2+O2↑ 棉花 防止冷凝水倒流使试管炸裂;(2)bc ;(3)检查装置的气密性;(4)气体的溶解度随温度的升高而减小,所以CO2气体在温水中的溶解度较小; (或降低CO2在水中的溶解度)。
(5)(a)20; (b)解:设产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑ (1分)
100 44
20g x (1分)
100/44 =20g/x x=8.8g (1分)
答:产生CO2的质量为8.8g
解析试题分析:(1)如果用高锰酸钾或氯酸钾制氧气就需要加热,加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;试管口略微向下倾斜,原因是:防止冷凝水倒流使试管炸裂;(2)实验室制取某气体时,即可用D(向下排空气法)也可用E装置(排水法)收集,由此推测该气体所具有的物理性质是:该气体难溶于水,该气体的密度小于空气;(3)实验室制取CO2的首要主要步骤是:连接好装置,检查装置的气密性;(4)若要用装置E收集CO2气体,要将水换成温水,其理由是:气体的溶解度随温度的升高而减小,所以CO2气体在温水中的溶解度较小; (5)(a)由图象可知:石灰石样品中CaCO3的质量=24g-4g=20g; (b)设产生CO2的质量为x,已知碳酸钙为20g,用CaCO3+2HCl=CaCl2+H2O+CO2↑ 即可求得二氧化碳的质量。
考点:常用气体的发生装置和收集装置与选取方法;实验室制取氧气的反应原理;制取二氧化碳的操作步骤和注意点;根据化学反应方程式的计算

 名校课堂系列答案
名校课堂系列答案甲和乙反应可制备燃料丙,其微观示意图如下.下列说法错误的是( )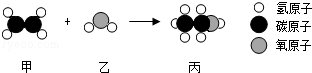
| A.该反应属于化合反应 | B.该反应中分子和原子的种类都发生了改变 |
| C.甲、丙是有机物,乙是氧化物 | D.甲、丙分别在氧气中完全燃烧,产物相同 |
工业上以CaO和HNO3为原料制备Ca(NO3)2?6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸的溶质质量分数约为
| A.41.2% | B.53.8% | C.58.3% | D.70.0% |
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响 (写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为 .