题目内容
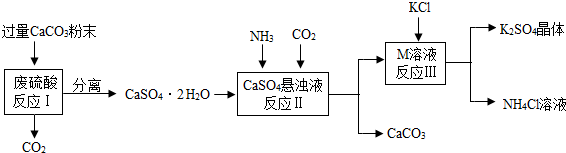
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物.
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
|
物质 |
KCl |
K2SO4 |
NH4Cl |
M |
|
溶解度/g(25℃) |
34.0 |
11.1 |
37.2 |
19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4•2H2O加热分解的产物.
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
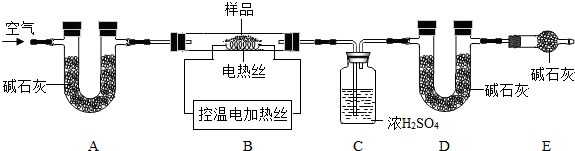
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.

①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
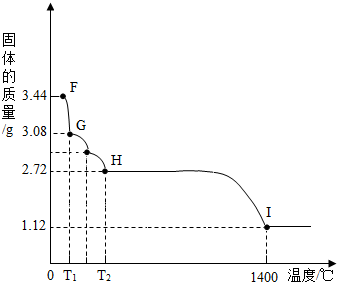
(7)CaSO4•2H2O受热会逐步失去结晶水.取纯净CaSO4•2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .
(1)加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分).
(2)CaCO3
(3)常温下K2SO4的溶解度小.
(4)减少K2SO4的溶解.c a
(5)CaCO3+2HCl=CaCl2+CO2↑+H2O
(6)①检查装置的气密性.除去空气中的CO2和H2O(意思相近均给分).②偏小 b、c
(7)①CaSO4•H2O
②2CaSO4 2CaO+2SO2↑+O2↑
2CaO+2SO2↑+O2↑
【解析】
试题分析:(1)将CaCO3研成粉末,可以增大反应物的接触面积,其目的是加快反应速率.(2)观察上述流程,发现二氧化碳和碳酸钙既是反应物也是生成物,故可循环使用的物质有CO2和CaCO3.(3)根据复分解反应发生的条件,反应Ⅲ中随没有不溶物,但常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,故反应可以进行.(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是减少K2SO4的溶解;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净.(5)碳酸钙能与稀盐酸反应,硫酸钙和稀盐酸不反应,故分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式CaCO3+2HCl=CaCl2+CO2↑+H2O.(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,①实验前首先要检查装置的气密性,再装入样品.装置A的作用是除去空气中的CO2和H2O,防止它们影响实验结果.②装置E的作用是吸收空气中的水和二氧化碳,如没有装置E,则实验测定结果将偏小.通过装置C可确定生成水的质量,故还可选用上述的bc两个数据组合也可求出x:y的值.(7)CaSO4•2H2O受热会逐步失去结晶水.取纯净CaSO4•2H2O固体,放在(5)的实验装置B中进行加热,①G点处减少的质量是失去了部分结晶水后的质量,故此时固体的化学式是CaSO4•H2O.②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,说明生成了二氧化硫气体,则H~I段发生反应的化学方程式为 2CaSO4 2CaO+2SO2↑+O2↑.
2CaO+2SO2↑+O2↑.
考点:物质的相互转化和制备;实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
点评:此题全面考查了学生对知识的掌握和应用能力,难度比较大,解答时一定要注意知识的前后的联系和综合运用.

 阅读快车系列答案
阅读快车系列答案某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物.
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
|
物质 |
KCl |
K2SO4 |
NH4Cl |
M |
|
溶解度/g(25℃) |
34.0 |
11.1 |
37.2 |
19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4•2H2O加热分解的产物.
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.

①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4•2H2O受热会逐步失去结晶水.取纯净CaSO4•2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .
某实验小组利用废硫酸液制备K2SO4并研究CaSO4?2H2O加热分解的产物.
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是______.
(2)上述流程中可循环使用的物质有CO2和______(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是______.
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4?2H2O加热分解的产物.
(5)分离所得的CaSO4?2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式______.
(6)为了测定CaSO4?2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.

①实验前首先要______,再装入样品.装置A的作用是______.
②已知CaSO4?2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______(填“偏大”、“偏小”或“无影响”).你认为还可选用上述的______(选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4?2H2O受热会逐步失去结晶水.取纯净CaSO4?2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是______.

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为______.
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4?2H2O加热分解的产物.
(5)分离所得的CaSO4?2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
(6)为了测定CaSO4?2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.

①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO4?2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4?2H2O受热会逐步失去结晶水.取纯净CaSO4?2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .