题目内容
【题目】A,B,C三种固体物质的溶解度曲线如图所示,回答下列问题: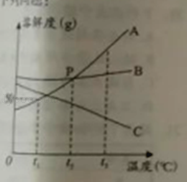
(1)当A中混有少量的B,常用的提纯方法是 .
(2)将A,B,C三种物质的饱和溶液从t2℃将到t1℃,所得溶液中溶质的质量分数关系由大到小的顺序是 .
(3)说出图中P点表示的意义 .
(4)t1℃,将50gA物质放于50g水中,充分溶解后,所得溶液的质量是g.
【答案】
(1)降温结晶
(2)B、A、C
(3)t2℃时,A、B物质的溶解度相等
(4)75
【解析】解:(1)A物质的溶解度受温度影响变化较大,所以当A中混有少量的B,常用的提纯方法是降温结晶;(2)t1℃时,B物质的溶解度最大,C物质的溶解度次之,A物质的溶解度最小,降低温度,A、B物质会析出晶体,C物质不会,C物质应该按照t2℃时的溶解度计算,所以将A,B,C三种物质的饱和溶液从t2℃将到t1℃,所得溶液中溶质的质量分数关系由大到小的顺序是B、A、C;(3)图中P点表示的意义是:t2℃时,A、B物质的溶解度相等;(4)t1℃,A物质的溶解度是50G,所以将50gA物质放于50g水中,充分溶解后,所得溶液的质量是75g.
所以答案是:(1)降温结晶;(2)B、A、C;(3)t2℃时,A、B物质的溶解度相等;(4)75.
【考点精析】解答此题的关键在于理解结晶的原理、方法及其应用的相关知识,掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3),以及对固体溶解度曲线及其作用的理解,了解1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).