题目内容
某废液中含有硫酸锌、硫酸镍(NiSO4)、硫酸铜和硫酸,初三化学兴趣小组欲从中回收铜和硫酸锌晶体.
老师给出信息:锌铜镍的金属的活动性:Zn>Ni>H>Cu
同学们按照实验目的设计了以下实验方案,请你协助完成方案:

(1)实验操作a和b都要用到的玻璃仪器是 .
(2)M是 ;固体Y中含有 ;写出X与废水中的物质发生反应的其中一个化学方程式 .
老师给出信息:锌铜镍的金属的活动性:Zn>Ni>H>Cu
同学们按照实验目的设计了以下实验方案,请你协助完成方案:

(1)实验操作a和b都要用到的玻璃仪器是
(2)M是
考点:金属的化学性质,过滤的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:从框图中可以看出:加入足量的金属X后获得的是固体Y和硫酸锌溶液,由于实验目的是回收铜和硫酸锌晶体,加入的金属X须能把铜从硫酸铜中置换出来,且不能加入新的杂质,把以金属X是锌,加入足量的锌后,由于金属活动性由强到弱的顺序为Zn、Ni、H、Cu.则锌可以和硫酸镍反应生成金属镍和硫酸锌,反应的化学方程式为:Zn+NiSO4=ZnSO4+Ni;锌和硫酸铜反应生成硫酸锌和铜,反应的化学方程式为:Zn+CuSO4=ZnSO4+Cu;锌、镍可和硫酸反应而铜不能和硫酸反应分离出铜即可.
解答:解:加入足量的金属X后获得的是固体Y和硫酸锌溶液,由于实验目的是回收铜和硫酸锌晶体,加入的金属X须能把铜从硫酸铜中置换出来,且不能加入新的杂质,把以金属X是锌,加入足量的锌后,由于金属活动性由强到弱的顺序为Zn、Ni、H、Cu.则锌可以和硫酸镍反应生成金属镍和硫酸锌,反应的化学方程式为:Zn+NiSO4=ZnSO4+Ni;锌和硫酸铜反应生成硫酸锌和铜,反应的化学方程式为:Zn+CuSO4=ZnSO4+Cu;锌、镍可和硫酸反应而铜不能和硫酸反应分离出铜,因此:
(1)由上面的分析可知实验操作a是过滤,操作b是蒸发,二者都要用到的玻璃仪器是玻璃棒;故答案为:玻璃棒;
(2)由上面的分析可知X是锌,固体Y中含有过量的锌及置换出的镍、铜;锌可以和硫酸镍反应生成金属镍和硫酸锌,反应的化学方程式为:Zn+NiSO4=ZnSO4+Ni;锌和硫酸铜反应生成硫酸锌和铜,反应的化学方程式为:Zn+CuSO4=ZnSO4+Cu;
故答案为:锌;锌、镍、铜;Zn+CuSO4=ZnSO4+Cu或Zn+NiSO4=ZnSO4+Ni.
(1)由上面的分析可知实验操作a是过滤,操作b是蒸发,二者都要用到的玻璃仪器是玻璃棒;故答案为:玻璃棒;
(2)由上面的分析可知X是锌,固体Y中含有过量的锌及置换出的镍、铜;锌可以和硫酸镍反应生成金属镍和硫酸锌,反应的化学方程式为:Zn+NiSO4=ZnSO4+Ni;锌和硫酸铜反应生成硫酸锌和铜,反应的化学方程式为:Zn+CuSO4=ZnSO4+Cu;
故答案为:锌;锌、镍、铜;Zn+CuSO4=ZnSO4+Cu或Zn+NiSO4=ZnSO4+Ni.
点评:本题属于金属活动性顺序的考查,熟记并知道金属活动顺序表的用途,并会运用金属活动顺序表解决实际的问题是解题的关键.

练习册系列答案
相关题目
下列说法中你认为正确的是( )
| A、中和反应一定是复分解反应 |
| B、有沉淀生成的化学反应一定是复分解反应 |
| C、中和反应一定是放热的 |
| D、用湿润的pH试纸测定未知溶液的酸碱度 |
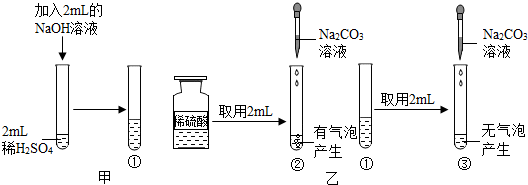
 在盐酸除铁锈的实验中,我们常会发现生锈的铁钉表面有一些气泡产生,气泡是怎么产生的?针对这一问题,同学们提出了有关假设,并设计了如图甲所示的实验方案进行探究,实验时,观察到放有铁的试管中有气泡产生,而另一试管中没有,从而验证了自己的假设是成立的.
在盐酸除铁锈的实验中,我们常会发现生锈的铁钉表面有一些气泡产生,气泡是怎么产生的?针对这一问题,同学们提出了有关假设,并设计了如图甲所示的实验方案进行探究,实验时,观察到放有铁的试管中有气泡产生,而另一试管中没有,从而验证了自己的假设是成立的.