题目内容
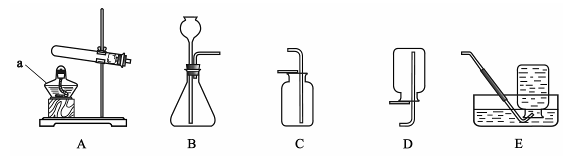
(9分)根据下列实验装置图,回答有关问题。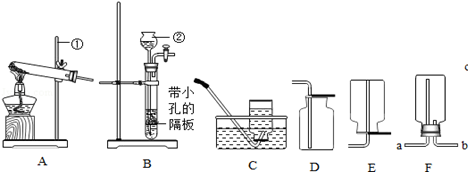
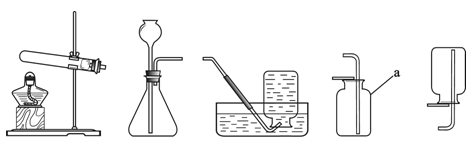
(1)指出编号仪器名称:① ,② 。
(2)实验室利用A装置可制取氧气,反应的化学方程式为 。
(3)实验室制取并收集氢气应选择的装置是 (从A~E中选择),反应的化学方程式为 ,使用该套装置制取气体的优点是 ,若用F装置收集氢气,则气体应从 端进入。
(4)用块状石灰石和稀盐酸反应,观察到气泡逸出不明显后,测得试管内残留液的pH如下图中a点所示,向残留液中逐渐滴入碳酸钠溶液,并用pH计连续监测测得的曲线如下图,(pH为纵坐标,时间(秒)为横坐标)。请写出曲线中bc段发生反应的化学方程式: ,cd上升的原因是 。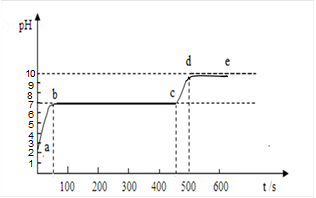
(1)①铁架台 ②长颈漏斗
2KClO3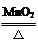 2KCl + 3O2↑
2KCl + 3O2↑
BC/BE H2SO4 + Zn = ZnSO4 + H2↑ 即开即停 a
CaCl2 + Na2CO3 ="==" CaCO3↓+ 2NaCl Na2CO3过量,呈碱性
解析试题分析:(1)常见仪器的识记
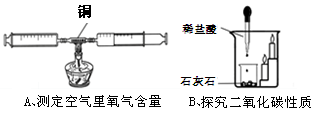
(2)实验室利用A装置可制取氧气,适用于固体和固体在加热条件下反应,所以反应化学方程式为:
2KClO3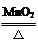 2KCl + 3O2↑
2KCl + 3O2↑
(3)实验室制取气体的发生装置的选择依据:反应物的状态和反应条件,收集装置的选择依据:气体的密度和溶解性,实验室制取氢气是用锌和稀硫酸反应,是固体和液体在常温下反应,生成的氢气密度比空气小且难溶于水,所以实验室制取并收集氢气应选择的装置是:BC/BE,反应的化学方程式为:H2SO4 + Zn = ZnSO4 + H2↑,使用该套装置,固体锌放在有孔的隔板上,能实现固液分离,所以优点是:可以随时控制反应的发生和停止,由于氢气的密度比空气小,若用F装置收集氢气,则气体应从a端进入
(4)用块状石灰石和稀盐酸反应,观察到气泡逸出不明显后,试管内残留液成分可能是CaCl2溶液,也可能是CaCl2和HCl的混合溶液,通过观察PH的变化情况,试管内残留液成分应是CaCl2和HCl的混合溶液,此时加入碳酸钠溶液,是先和HCl溶液反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,即曲线图中的ab段,当HCl溶液反应完全,继续与CaCl2溶液反应:CaCl2+Na2CO3==CaCO3↓+2NaCl,即直线bc段,cd上升的原因是:Na2CO3过量,呈碱性
考点:实验室制取气体的发生、收集装置的选择,制取氧气、氢气的反应原理,反应后溶液中溶质的判断



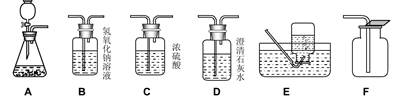
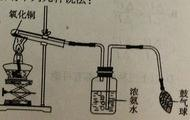
 3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法:
3Cu+3H2O+N2,如下图所示,挤压鼓气球把空气鼓入盛有浓氨水的集气瓶中,使氨气进入试管,用酒精灯给试管加热,即可达到实验目的。关于该实验,有下列几种说法: